КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Пандемия СOVID-19: систематический обзор клинических исследований лекарственных препаратов
1 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Минздрава России, 197022, Российская Федерация, Санкт-Петербург, вн.тер.г. муниципальный округ, Аптекарский остров, ул. Профессора Попова, д. 14, литера А.
2 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Минздрава России, 197022, Российская Федерация, Санкт-Петербург, вн.тер.г. муниципальный округ, Аптекарский остров, ул. Профессора Попова, д. 14, литера А.
3 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Минздрава России, 197022, Российская Федерация, Санкт-Петербург, вн.тер.г. муниципальный округ, Аптекарский остров, ул. Профессора Попова, д. 14, литера А.
4 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Минздрава России, 197022, Российская Федерация, Санкт-Петербург, вн.тер.г. муниципальный округ, Аптекарский остров, ул. Профессора Попова, д. 14, литера А.
5 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Минздрава России, 197022, Российская Федерация, Санкт-Петербург, вн.тер.г. муниципальный округ, Аптекарский остров, ул. Профессора Попова, д. 14, литера А.
6 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Рязанский государственный медицинский университет имени академика И. П. Павлова» Министерства здравоохранения Российской Федерации, 390026, Российская Федерация, г. Рязань, ул. Высоковольтная, д. 9.
На глобальном фармацевтическом рынке в период до 2036 года ожидается завершение масштабных клинических исследований, определяющих вектор инновационных медицинских технологий, что позволит расширить доказательную базу известных лекарственных препаратов. На долю исследований с уникальным идентификационным кодом приходится 26,3%. Стремительно растет количество клинических исследований в отношении препаратов, используемых с профилактической целью. Важно подчеркнуть, что доля клинических исследований, которые посвящены изучению матричных вакцин, составляет 82% в общей совокупности всех исследований.
В статье представлен систематический обзор и анализ клинических исследований лекарственных препаратов для профилактики и терапии Covid-19, который позволил выявить, что на глобальном фармацевтическом рынке в ближайшие годы ожидается завершение 1909 масштабных клинических исследований, определяющих вектор формирования новых медицинских технологий и/или расширяющих доказательную базу известных препаратов. Наряду с этим увеличивается количество клинических исследований, направленных на профилактику Covid-19, в частности, в отношении вакцин, преимущественно матричных, что, в свою очередь, будет способствовать снижению риска распространения патологии.
Ключевые слова: клинические исследования лекарственных препаратов, вакцина от Covid-19, препараты для профилактики и терапии Covid-19, инновационные медицинские технологии, матричные вакцины
Введение
Эпидемия Covid-19, вызванная коронавирусом (SARS-CoV-2), стала индикатором устойчивости систем здравоохранения как отдельных государств, так и системы охраны здоровья в целом, определяя необходимость адаптации традиционных принципов и подходов к лекарственному обеспечению населения в условиях пандемических вызовов. По данным Всемирной организации здравоохранения, на период с 2020 по 2024 гг. зарегистрировано 775 645 882 случаев заражения Covid-19, из которых 7 051 876 – с летальным исходом, что в десятки раз превышает показатели заболеваемости и летальности в отношении традиционных инфекций [1–4].
В связи с тяжелым социально-экономическим бременем как самой патологии, так и ее последствий, особый интерес представляют исследования, направленные на поиск современных методов диагностики, профилактики и терапии пациентов с инфекционными заболеваниями, представляющими угрозу для окружающих [5–6]. Подобные исследования имеют критическое значение для обеспечения системы здоровьесбережения населения и снижения нагрузки на систему здравоохранения [7–10].
Цель исследования
Провести систематический обзор клинических исследований (КИ) лекарственных препаратов для профилактики и терапии Covid-19.
Материалы и методы
База исследования создана на основании данных международного регистра КИ (clinicaltrials.gov), реестра разрешений на проведение КИ в Российской Федерации (grls.minzdrav.gov) за период с 2019 по 2024 гг. [11–12]. Для проектирования максимально корректного дизайна исследования сформирован информационный массив, описывающий 1909 испытаний. Поиск осуществлялся по ключевому слову «Covid-19» с включением параметров: фаза проведения, вид КИ, место проведения, количество и демографические характеристики участников исследования, вид терапии, на которую направлен исследуемый препарат. В статье под новыми лекарственными препаратами (ЛП) понимали незарегистрированные на глобальном фармацевтическом рынке позиции [1–5].
Результаты и обсуждение
Проведенный систематический поиск позволил выявить и отобрать для анализа 1909 КИ, из которых 1780 ссылок опубликовано в международном регистре КИ, 129 – в реестре разрешений на проведение КИ в Российской Федерации (рис. 1).
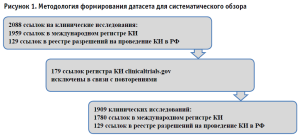
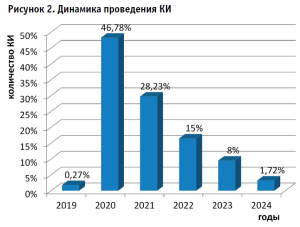
Оценка сформированного датасета позволяет заключить, что 1811 КИ являются завершенными, из которых 363 исследования имеют опубликованный результат на текущий момент (рис. 2). При этом 46,78% КИ инициированы в 2020 году, что подчеркивает оперативное реагирование на глобальные угрозы здравоохранению и приоритетность совершенствования механизмов быстрого запуска КИ в условиях чрезвычайных ситуаций.
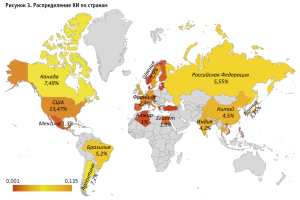
Установлено, что КИ относительно профилактики и терапии Covid-19 инициированы в 44 государствах. На основании анализа территориальной сконцентрированности испытаний выявлено, что наибольшее число КИ реализовано в США и Канаде, составляя 13,47% и 7,49% матрицы, соответственно (рис. 3). Географическую вариативность глобальных усилий в условиях распространения высококонтагиозной инфекции подчеркивает участие различных регионов в проведении КИ, включая Азию, Восточную Европу и Африку. При этом вовлеченность широкого круга стран позволяет учитывать клинико-эпидемиологические особенности инфекции в регионах, что способствует разработке и внедрению эффективных медицинских технологий на международном уровне.
Сравнительный анализ базы данных позволяет утверждать, что превалирующая (95,5%) доля испытаний относится к «контролируемым». Последнее свидетельствует о высоком уровне стандартизации и надежности не только проводимых испытаний, но и методологических подходов, обеспечивая валидность полученных результатов.
Определено, что 61,13% проводимых КИ реализованы в формате «слепых», когда участники и/или исследователи не осведомлены о вводимом препарате. При этом в рамках формата «слепых» исследований превалирует метод «двойного ослепления» с охватом 52,02%, метод «простого ослепления» использован в 10,45% случаев, тогда как «тройное ослепление» затрагивает 37,53% КИ.
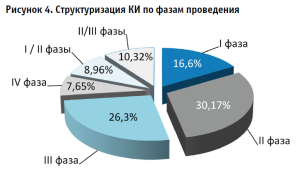
Случаи проведения КИ одновременно на I и II фазе для оценки действия препарата на организм здорового человека регистрируются в 8,96% случаев. Проведенный анализ зарегистрированных КИ демонстрирует, что наибольшее количество исследований находились/находятся на II фазе (30,17%), целью которой является определение оптимальной дозы и режима введения для исследований III фазы. На долю исследований II и III фаз, ориентированных на формирование статистики по безопасности и клинической эффективности применения препарата, возможным побочным эффектам и осложнениям, а также оценку вероятности расширения показаний к применению исследуемого препарата суммарно приходится 10,32% (рис. 4).
Исследование портрета участника позволило определить, что в подавляющем (94,66%) большинстве случаев в КИ принимали участие лица в возрасте от 18 до 74 лет, значимых различий по гендерному признаку не выявлено. Необходимо отметить, что менее 5% КИ ориентированы исключительно на изучение эффективности и безопасности ЛП для применения в педиатрической практике и лиц старше 60 лет (табл. 1). Полученные данные позволяют утверждать о потенциальных клинических рисках терапии пациентов данных возрастных групп.
Установлено, что 51,17% КИ проведены/проводятся в рамках изучения эффективности препаратов для терапии Covid-19, в то время как на профилактику ориентировано менее 50% позиций. При этом на территории Российской Федерации 62,2% исследований посвящено изучению эффективности препаратов для лечения Covid-19. Полученные данные свидетельствуют о том, что наметившийся вектор отражает сбалансированный подход в части оценки эффективности фармакотерапии и разработки эффективных стратегий сдерживания пандемии.
Углубленный анализ КИ показал, что 27,55% исследований посвящены вопросам патогенетической терапии Covid-19, в то время, как на этиотропную и симптоматическую линии отведено 14,35% и 9,27% КИ соответственно (табл. 2).

Сравнительный анализ проведенных/ проводимых КИ препаратов для этиотропной терапии демонстрирует, что исследования новых ЛП составляют 41,2%. В тоже время КИ, ориентированные на оценку присутствующих на рынке позиций категории J05 «Противовирусные препараты системного действия» зарегистрированы в 35,76% случаев, группы J01 «Антибактериальные препараты системного действия» охватывают 23,04%.
Стоит подчеркнуть, что лидером в рамках категории J05 «Противовирусные препараты системного действия» выступает ремдесивир с охватом 28,60%. Наряду с этим, исследуются ритонавир (24,50%), лопинавир (18,36%), нирматрелвир (18,36%) и фавипиравир (10,18%). Детальное изучение КИ препаратов группы J05 «Противовирусные препараты системного действия» показывает, что 53,08% КИ находятся на III фазе, что подтверждает высокую активность в области разработки и тестирования новых противовирусных препаратов, обосновывающих появление новых медицинских технологий для лечения вирусных инфекций.
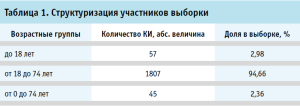
Контент-анализ категории J01 «Антибактериальные препараты системного действия» демонстрирует, что исследуются препараты азитромицина (61,96%), доксициклина (19,04%), цефуроксима (9,5%) и цефтриаксона (9,5%). Установлено, что анализируемая группа препаратов находится преимущественно на II фазе испытаний, составляя 58,7% случаев в выборке (рис. 5).
Выявлено, что в 53,8% КИ изучается эффективность и безопасность новых ЛП для патогенетической терапии (рис. 6). Детальный анализ в отношении присутствующих в обращении позиций демонстрирует превалирование группы L04 «Иммунодепрессанты», которая составила 16,9% от общего числа исследований. Структуризация группы показывает, что лидерами по проводимым КИ являются тоцилизумаб (32,5%), сиролимус (22,47%), анакинра (22,47%). Доминантное преимущество данной категории в структуре КИ свидетельствует о высоком интересе клиницистов к улучшению клинических исходов у пациентов с Covid-19.
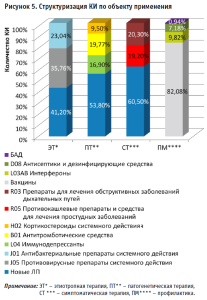
В течение анализируемого периода зарегистрировано 104 КИ (19,77%) в части оценки препаратов из группы B01 «Антитромботические средства» с превалированием исследований гепарина (37,26%) (рис. 6).
Анализ позволил определить, что 9,5% КИ приходится на группу H02 «Кортикостероиды системного действия». Необходимо отметить, что превалируют исследования в отношении дексаметазона, охватывая 50% случаев, при этом метилпреднизолон и преднизолон составляют 36% и 14% оцениваемой матрицы, соответственно.
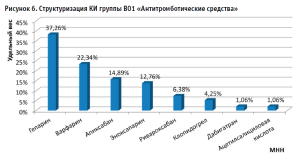
В рамках анализа КИ лекарственных препаратов, рекомендованных для симптоматической терапии Covid-19 выявлено, что 60,4% испытаний направлены на изучение и оценку влияния «новых» ЛП, в то время как 39,6% испытаний приходится на долю существующих/зарегистрированных препаратов группы R «Дыхательная система» (рис. 6). Лидерами по количеству испытаний являются препараты групп R03 «Препараты для лечения обструктивных заболеваний дыхательных путей» и R05 «Противокашлевые препараты и средства для лечения простудных заболеваний», охватывая 20,4%, и 19,2% матрицы, соответственно (рис. 7).
Контент-анализ матрицы испытаний показывает, что подавляющая (82,08%) часть КИ, посвященных профилактике, направлена на исследования эффективности вакцин. Необходимо отметить, что на территории Российской Федерации зарегистрировано 4,18% исследований вакцин. При этом наиболее часто проводились испытания Гам-КОВИД-Вак – комбинированной векторной вакцины для профилактики коронавирусной инфекции (13,8%), а также вакцины на основе пептидных антигенов ЭпиВакКорона (7,7%). Установлено, что в 9,8% случаев проводилась оценка «риск/польза» в отношении группы L03AB «Интерфероны» в качестве метода предупреждения распространения заболевания. Примечательно, что незначительное количество КИ, посвященных профилактической терапии, посвящены изучению эффективности антисептических средств – 7,18% и биологически активных добавок – 0,94%.
Следует подчеркнуть, что среди КИ, анонсированных к завершению в период с 2025 по 2036 годы, максимальная (42,5%) доля испытаний отведена оценке вакцин. Наряду с этим, на этиотропную терапию направлено 37,7% от общего числа исследований, симптоматическую – 7,5%, патогенетическую – 12,3% (рис. 8).
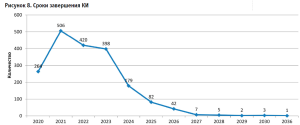
Структуризация текущих КИ для присутствующих на рынке лекарственных препаратов прогнозирует расширение показаний к применению ряда позиций из категорий противовирусных препаратов системного действия, иммунодепрессантов и вакцин (табл. 3).

Необходимо подчеркнуть, что до 2036 года на фармацевтический рынок ожидается выход новых лекарственных препаратов, зарегистрированных в соответствующих реестрах под уникальными идентификационными кодами. Доля таких исследований составляет 26,3% от общей совокупности КИ, что свидетельствует о значительном потенциале для внедрения инновационных терапевтических подходов.
Заключение
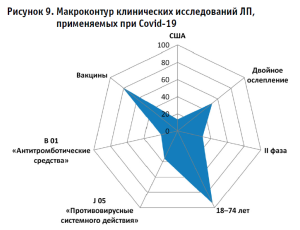
В результате систематизации полученных данных (рис. 9) установлено, что в 30,2% рассматриваемых КИ тестирование затрагивает II фазу с применением «двойного ослепления» (52%). Лидером по количеству зарегистрированных КИ в рамках глобальной практики выступают США, охватывая 13,47% матрицы. Портрет участника КИ позволяет определить, что в подавляющем большинстве (94,65%) испытаний принимают участие лица в возрасте от 18 до 74 лет. При этом на глобальном фармацевтическом рынке в ближайшие годы ожидается завершение 1909 масштабных КИ, определяющих вектор формирования новых медицинских технологий и/или расширяющих доказательную базу известных препаратов. Наряду с этим увеличивается количество КИ, направленных на профилактику Covid-19, в частности, в отношении вакцин, преимущественно матричных, что, в свою очередь, будет способствовать снижению риска распространения патологии.
- Омельяновский В.В., Антонов А.А., Безденежных Т.П., Хачатрян Г.Р. Систематический обзор актуальных научных сведений о применении лекарственных препаратов в терапии новой коронавирусной инфекции COVID-19 // Медицинские технологии. Оценка и выбор. – 2020. – № 1 (39). С. 8–18.
- Lythgoe M P., Middleton P. Ongoing сlinical trials for the management of the COVID-19 pandemic. Trends pharmacol Sci. 2020; 41 (6): 363–382. DOI: 10.1016/j.tips.2020.03.006.
- Tavakol S., Alavijeh M.S., Seifalian A.M. COVID-19 vaccines in clinical trials and their mode of action for immunity against the virus. Curr Pharm Des. 2021; 27(13): 1553–1563. DOI: 10.2174/1381612826666201023143956.
- Singh V., Garg S. Klimek M., Sinha R.R., Dhanwal D. COVID-19 and сlinical trials: current challenges and future directions. Rev Recent Clin Trials. 2021. 16(3): 258–261. DOI: 10.2174/1574887116666210122160705.
- Pencina M.J., Thompson B.T. Key concepts of clinical trials: a narrative review. NEJM Evid. 2022; 123(5): 194–204. DOI: 10.1056/EVIDctw2200060.
- Nemyatykh O.D., Maistrenko M.A., Demchenko D.D., Narkevich I.A., Okovityi S.V., Timchenko V.N. Principles of rational COVID-19 therapy in pediatrics. Journal of clinical medicine. 2023; 12. DOI:10.3390/ jcm12144731.
- Nasyrov R.A., Ivanov D.O., Krasnogorskaya O.L., Timchenko V.N., Fedotova E.P., Chepelev A.S. et al. COVID-19 in Children. Molecular Profile and Pathological Features.2023; 24(23). DOI:10.3390/ijms242316750.
- Majumder J., Minko T. Recent developments on therapeutic and diagnostic approaches for COVID-19. AAPS J. 2021; 23(1); 14. DOI: 10.1208/s12248-020-00532-2.
- Mughees M., Chugh H., Naqvi S.H., Wajid S. COVID-19 Threat to the World: Current and possible diagnostic. Treatment strategies. Crit Rev Biomed Eng.2021; 49(1): 21–33. DOI: 10.1615/CritRevBiomedEng.2021036595.
- Сиукаева Д.Д., Немятых О.Д., Наркевич И.А., Павленко Н.И. Комплексная маркетинговая оценка рынка лекарственных средств для лечения пневмонии у детей. Разработка и регистрация лекарственных средств. 2017; (4): 292–296.
- Международный регистр клинических исследований. Ссылка активна на 24.06.2025. https://clinicaltrials.gov/
- Реестр разрешений на проведение клинических исследований лекарственных препаратов для медицинского применения. Ссылка активна на 24.06.2025. https://grls.minzdrav.gov.ru/CIPermitionReg.aspx.
