КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Организация и проведение контроля качества лекарственных средств в новых условиях
1 — Федеральная служба по надзору в сфере здравоохранения, 109074, Российская Федерация, Москва, Славянская площадь, д. 4, стр. 1.
2 — Федеральная служба по надзору в сфере здравоохранения, 109074, Российская Федерация, Москва, Славянская площадь, д. 4, стр. 1.
В статье представлен обзор работы Федеральной службы по надзору в сфере здравоохранения в рамках федерального государственного контроля (надзора) в сфере обращения лекарственных средств по подтверждению соответствия лекарственных средств, находящихся в обращении, показателям качества, эффективности и безопасности, установленным при их регистрации, а также по использованию информационных систем при контрольных (надзорных) мероприятиях Росздравнадзора и международной деятельности.
Ключевые слова: выборочный контроль качества лекарственных средств, федеральные лабораторные комплексы, ввод в гражданский оборот лекарственных препаратов, противодействие незаконному обороту лекарственных средств, информационные системы, стандартные образцы, система мониторинга движения лекарственных препаратов
Введение
Федеральная служба по надзору в сфере здравоохранения осуществляет федеральный государственный контроль (надзор) в сфере обращения лекарственных средств. Требования к организации и проведению контрольных (надзорных) мероприятий регламентированы положениями Федерального закона от 31.07.2020 № 248-ФЗ «О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации», вступившими в силу с 01.07.2021; постановления Правительства Российской Федерации от 29.06.2021 № 1049 «О федеральном государственном контроле (надзоре) в сфере обращения лекарственных средств», вступившими в силу с 01.07.2021; постановления Правительства Российской Федерации от 10.03.2022 № 336 «Об особенностях организации и осуществления государственного контроля (надзора), муниципального контроля».
Федеральный государственный контроль (надзор) в сфере обращения лекарственных средств. Проведение выборочного контроля качества
При осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств проводятся следующие виды контрольных (надзорных) мероприятий:
а) документарная проверка;
б) выездная проверка;
в) выборочный контроль качества;
г) контрольная закупка;
д) инспекционный визит;
е) наблюдение за соблюдением обязательных требований (мониторинг безопасности) (фармаконадзор).
Проведение экспертизы качества лекарственных средств возможно при выездной проверке, выборочном контроле качества и в рамках фармаконадзора.
В настоящее время плановые проверки в соответствии с постановлением Правительства Российской Федерации от 10.03.2022 № 336 проводятся только в отношении организаций чрезвычайно высокого и высокого риска.
В 2022 году внеплановые контрольные (надзорные) мероприятия, внеплановые проверки проводились исключительно по следующим основаниям:
а) при условии согласования с органами прокуратуры:
- при непосредственной угрозе причинения вреда жизни и тяжкого вреда здоровью граждан, по фактам причинения вреда жизни и тяжкого вреда здоровью граждан;
- при выявлении индикаторов риска нарушения обязательных требований в отношении объектов чрезвычайно высокого и высокого рисков;
- в случае необходимости проведения внеплановой выездной проверки в связи с истечением срока исполнения предписания.
б) без согласования с органами прокуратуры:
- по поручению Президента и Председателя Правительства и Российской Федерации;
- по поручению Заместителя Председателя Правительства Российской Федерации, согласованному с Заместителем Председателя Правительства Российской Федерации – Руководителем Аппарата Правительства Российской Федерации;
- по требованию прокурора в рамках надзора за исполнением законов, соблюдением прав и свобод человека и гражданина по поступившим в органы прокуратуры материалам и обращениям;
- наступление события, указанного в программе проверок.
Выборочный контроль качества лекарственных средств всегда носит внеплановый характер и может проводиться по согласованию с органами прокуратуры или без согласования с органами прокуратуры, в том числе на основании программы проверок.
Программа проверок формируется на календарный год в срок до 30 декабря года, предшествующего году проведения выборочного контроля, и оформляется приказом Росздравнадзора.
Программа проверок формируется ежегодно по результатам выборочного контроля качества лекарственных средств за предыдущие периоды; данным о выявлении недоброкачественных и фальсифицированных лекарственных средств; данным, в обязательном порядке предоставляемым субъектами обращения лекарственных средств, о сериях, партиях лекарственных средств, поступающих в гражданский оборот в Российской Федерации; поступившим сведениям по фармаконадзору о серьезных нежелательных реакциях; сведениям, поступившим от граждан, организаций и из средств массовой информации.
Программа проверок включает как отдельные группы лекарственных препаратов, сгруппированные по АТХ, так и препараты конкретных международных непатентованных наименований.
В ходе проведения выборочного контроля могут осуществляться следующие контрольные (надзорные) действия: осмотр, опрос (при проведении проверки), получение письменных объяснений, истребование документов, отбор образцов лекарственных средств, инструментальное обследование, испытание, экспертиза на соответствие установленным требованиям к качеству.
Цифровая платформа мониторинга контроля и надзора в Российской Федерации
В ходе реформы контрольно-надзорной деятельности в Российской Федерации создается цифровая платформа мониторинга контроля и надзора – все существующие сейчас информационные системы, задействованные в ней, будут связаны. Платформа объединит информационные системы органов, участвующих в контрольно-надзорной деятельности, будет обеспечивать аналитическую обработку информации в режиме реального времени на территории всей страны. Цифровая платформа охватывает как функции контрольно-надзорных органов, так и государственные услуги.
Юридические лица через личный кабинет на Едином портале государственных и муниципальных услуг (функций) (ЕПГУ) имеют доступ ко всей информации, а также возможность подачи заявлений на осуществление необходимых государственных услуг.
Инструментом оценки деятельности контрольно-надзорных органов, а также их эффективности и результативности является государственная автоматизированная информационная система «Управление».
1 июля 2021 года в России заработал Единый реестр видов государственного контроля (надзора) (рис. 1). В него включена информация о всех видах контроля (надзора) федерального, регионального и муниципального уровней, а также их описание. Кроме того, в реестре указано, какие надзорные органы осуществляют конкретный вид контроля.
Доступность информации позволит бизнесу изучить подробное описание каждого вида контроля, а также узнать, с какой периодичностью будут осуществляться проверки в отношении их деятельности.
Реестр обязательных требований – это единая платформа, на которой собрана информация обо всех обязательных требованиях к бизнесу, которые проверяются в рамках контроля (надзора) и при выдаче разрешений. За методическое обеспечение наполнения Реестра отвечает Минэкономразвития России.
Реестр обязательных требований не только является общедоступной платформой для предпринимателей, но и интегрирован с другими системами контрольно-надзорной деятельности. Информация об обязательных требованиях будет использоваться при составлении планов проверок и оформлении результатов контрольно-надзорных мероприятий.
В рамках функций и оказываемых услуг Росздравнадзор наполняет реестр обязательных требований соответствующими нормативными правовыми актами и обязательными требованиями.
С 1 июля 2021 года введена в промышленную эксплуатацию Федеральная государственная информационная система «Единый реестр контрольных (надзорных) мероприятий (ФГИС ЕРКНМ). Оператор системы – Генеральная прокуратура Российской Федерации (рис. 2).
Все мероприятия, как контрольно-надзорные (в том числе выборочный контроль качества), так и профилактические, вносятся в ФГИС ЕРКНМ.
ФГИС ЕРКНМ поддерживает совместную работу органов контроля (надзора) и органов прокуратуры в ходе планирования и согласования контрольных (надзорных) мероприятий. Для инициирования проверок органам контроля (надзора) требуется вносить запланированные и внеплановые мероприятия в ФГИС ЕРКНМ.
Система обеспечивает доступ со стороны сотрудников контрольных (надзорных) органов через личный кабинет и возможность работы с паспортами, списками и планами контрольных (надзорных) мероприятий, с шаблонами и статусами их загрузок.
Информационная система обеспечивает прозрачность всех проводимых контрольными (надзорными) органами мероприятий, ведет учет решений и действий должностных лиц и органов контроля.
ФГИС ЕРКНМ взаимодействует с внешними информационными системами. Реестр синхронизировали с порталом госуслуг. Через личные кабинеты на этом ресурсе контролируемые лица смогут отслеживать всю информацию о предстоящих проверках и видеть решения, принятые по итогам прошедших мероприятий.
Типовые формы документов, используемые контрольными (надзорными) органами, утверждены приказом Министерства экономического развития Российской Федерации от 31.03.2021 № 151 «О типовых формах документов, используемых контрольным (надзорным) органом». Для выборочного контроля качества – это типовая форма Решения о проведении выборочного контроля и форма акта выборочного контроля.
В соответствии с Федеральным законом от 31.07.2020 № 248-ФЗ «О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации» контрольный (надзорный) орган вправе утверждать формы документов, используемых им при осуществлении государственного контроля (надзора), муниципального контроля, не утвержденные Минэкономразвития России. Росздравнадзором разработаны и утверждены два приказа о формах документов, используемых при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств: от 10.03.2022 № 1745 «Об утверждении формы Акта возврата образцов лекарственных средств» и от 10.03.2022 № 1746 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств».
На все документы, оформляемые контрольным (надзорным) органом наносится QR-код, обеспечивающий переход на страницу, содержащую запись о контрольном (надзорном) мероприятии.
Государственная информационная система «Типовое облачное решение по автоматизации контрольной (надзорной) деятельности» (ГИС ТОР КНД) обеспечивает деятельность сотрудников органов контроля (надзора) с использованием «цифрового инспектора», формирующего различные типы заданий в результате анализа рисков, основанных на массивах больших данных, собранных на объектах контроля, и «доступных в человеко-воспринимаемой форме».
Целями функционирования ГИС ТОР КНД являются:
- обеспечение прозрачности деятельности ведомств;
- создание среды доверия для граждан и организаций;
- проведение цифровой трансформации государственных и муниципальных органов контроля;
- повышение эффективности и результативности деятельности контрольных органов за счет оперативного выявления признаков нарушения по результатам анализа рисков, основанного на массивах больших данных;
- предотвращение нарушения за счет применения методов предиктивной аналитики и возможности проведения индивидуализированных профилактических мероприятий.
В ГИС ТОР КНД входит информационная система досудебного обжалования как функций, так и государственных услуг.
В настоящее время проводится пилотный проект по ведению производства по делам об административных правонарушениях. По итогам проведения контрольного (надзорного) мероприятия в ФГИС ЕРКНМ фиксируется результат мероприятия, далее органом контроля в ГИС ТОР КНД формируется акт по результатам мероприятия, запускается задача по возбуждению административного делопроизводства, формируется протокол об административном правонарушении, рассматривается дело, документы направляются в личный кабинет контролируемого лица на портал ЕПГУ.
Таким образом, контрольная (надзорная) деятельность Росздравнадзора по организации и проведению контроля качества лекарственных средств не могла остаться в стороне от современных вызовов и необходимости использования информационных технологий. Невозможно осуществлять эффективную контрольную (надзорную) деятельность без использования информационных систем, которые способствуют реализации принципа обеспечения информационной открытости и клиентоцентричности. Работа Росздравнадзора в данном направлении будет продолжена.
Контроль качества лекарственных средств: результаты 2022 года
Лабораторные комплексы Федерального государственного бюджетного учреждения «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения (ФГБУ «ИМЦЭУАОСМП» Росздравнадзора) на текущий момент являются одними из самых оснащенных центров испытаний качества лекарственных средств. Материально-техническая база лабораторных комплексов регулярно обновляется в соответствии с требованиями как российской, так и зарубежных фармакопей.
Несмотря на введенный мораторий на проведение плановых, а также на ограничение внеплановых проверок, объем контроля качества лекарственных препаратов не снижается. Так, в 2022 году проведено 37 100 экспертиз. При этом 60% анализов проведено с использованием неразрушающих методов: БИК-спектрометрии и Раман-спектроскопии. Скрининг качества лекарственных средств с использованием неразрушающих методов проводится на базе 13 передвижных лабораторий, что позволяет проводить испытания качества лекарственных препаратов непосредственно в аптеке или медицинской организации.
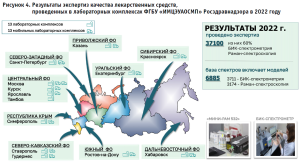
База спектров для проведения испытаний неразрушающими методами постоянно пополняется и сегодня включает 6885 моделей, что в целом на 27% больше, чем в 2021 году.
Данное направление требует дальнейшего развития, в том числе пополнения библиотеки спектров при регистрации новых препаратов, а также при внесении изменений в регистрационные досье уже зарегистрированных.
Созданная Росздравнадзором система государственного контроля качества лекарственных средств постоянно развивается, что позволяет не только проводить испытания лекарственных средств, но и своевременно выявлять и изымать из обращения недоброкачественные, фальсифицированные, незарегистрированные лекарственные средства, а также находящиеся в незаконном обороте лекарственные средства.
В 2022 году сохранена динамика снижения количества серий, изъятых из обращения (406 серий), что составляет 0,12% от общего количества серий, введенных в гражданский оборот.
Количество выявленных в обращении фальсифицированных препаратов в 2022 году, по сравнению с 2019 годом, значительно сократилось. Мы связываем это с внедрением системы маркировки в 2020 году.
При выявлении несоответствия требованиям к качеству лекарственных препаратов Росздравнадзор блокирует их движение в федеральной государственной информационной системе мониторинга движения лекарственных препаратов для медицинского применения (ФГИС МДЛП) и предотвращает поступление к потребителям недоброкачественных лекарственных препаратов.
Росздравнадзором в 2022 году приняты решения по блокировке 145 серий 56 торговых наименований недоброкачественных лекарственных препаратов, которые переданы в ФГИС МДЛП.
Благодаря уникальным кодам маркировки можно оперативно установить законных владельцев препаратов, что важно при подозрениях в краже из медицинских организаций. ФГИС МДЛП позволяет совместно с правоохранительными органами прослеживать движение легальной цепи поставок и предотвращать повторный вброс в обращение лекарственных препаратов.
В 2022 году Росздравнадзор традиционно принял участие в международной операции «Пангея», которая проводится под эгидой Интерпола и направлена на пресечение преступной деятельности, связанной с незаконным оборотом в сети Интернет лекарственных средств и медицинских изделий.
Росздравнадзором с территориальными органами проведено более 200 мероприятий, из них совместно с правоохранительными органами – 151.
По результатам принято решение о блокировке 973 выявленных интернет-ресурсов, на которых нелегально продавались лекарственные средства.
Стандартные образцы. Использование вторичных стандартных образцов
В связи с ограничительными мерами в отношении Российской Федерации, производители и дистрибьюторы лекарственных средств в настоящее время испытывают трудности с приобретением стандартных образцов фармакопейного качества иностранных фармакопей для проведения испытаний качества в рамках выпуска лекарственных препаратов в гражданский оборот, а также их предоставлением для проведения экспертизы образцов лекарственных средств в рамках выборочного контроля качества лекарственных средств для медицинского применения.
На сегодняшний день Европейская и Американская Фармакопеи не объявили о запрете поставок стандартных образцов в Российскую Федерацию, однако признают логистические сложности с поставкой.
Фармакопея Российской Федерации (Общая фармакопейная статья «Стандартные образцы. ОФС.1.1.0007.23», утвержденная приказом Минздрава России от 17.05.2023 № 236, дата введения в действие – 22.05.2023) позволяет использовать рабочие (вторичные) стандартные образцы, утвержденные в установленном порядке и аттестованные с использованием международных или фармакопейных стандартных образцов. Аттестация вторичных стандартных образцов может быть проведена при условии сохранения прослеживаемости к первичному образцу и не требует наличия метрологической службы или утверждения типа стандартных образцов.
Использование вторичных стандартных образцов также регламентировано правилами Надлежащей производственной практики Евразийского экономического союза, утвержденными решением Совета Евразийской экономической комиссии от 03.11.2016 № 77.
Аттестация вторичных стандартных образцов должна проводиться с учетом требований к соблюдению однородности и стабильности образца, его прослеживаемости и аттестации метрологических характеристик в соответствии с требованиями ISO Guide 80:2014 «Руководство по внутрилабораторному изготовлению материалов для контроля качества (МКК)».
Анализ предупредительных писем по итогам инспекций FDA за 2011– 2022 годы позволяет отметить, что некорректная аттестация вторичных стандартных образцов является достаточно частой причиной несоответствий установленным требованиям к качеству лекарственных средств.
ГОСТ ISO/IEC 17025-2019. «Межгосударственный стандарт. Общие требования к компетентности испытательных и калибровочных лабораторий» также допускает использование вторичных стандартных образцов, которые в терминологии ГОСТа описываются как «образцы, применяемые для внутреннего контроля качества».
ФГБУ «ИМЦЭУАОСМП» Росздравнадзора выполняет работы по аттестации рабочих (вторичных) стандартных образцов с сохранением прослеживаемости к первичному стандартному образцу по заявкам производителей лекарственных средств.
Международное сотрудничество Росздравнадзора с регуляторными органами иностранных государств и профильными международными организациями в 2022 году
В 2022 году в целях обеспечения защиты здоровья населения Российской Федерации Росздравнадзор взаимодействовал с зарубежными коллегами, в ходе сотрудничества перенимались лучшие практики, осуществлялся информационный обмен с использованием различных механизмов международного регуляторного взаимодействия.
В рамках работы по предотвращению распространения или предложения некондиционной и фальсифицированной медицинской продукции Росздравнадзор оперативно анализировал информацию ВОЗ о выявленных фактах распространения фальсифицированных, недоброкачественных или незарегистрированных лекарственных препаратов и медицинских изделий.
В начале 2022 года состоялся визит в Москву директора Департамента обращения лекарственных препаратов и преквалификации Всемирной организации здравоохранения Роджерио Гаспара, в ходе которого прорабатывались совместные шаги по аккредитации и включению российских регуляторных органов – Минздрава России, Минпромторга России и Росздравнадзора – в перечень регуляторных органов ВОЗ (WHO Listed authorities). Также в ходе визита эксперты ВОЗ ознакомились с работой российских лабораторий по контролю качества лекарственных средств.
Эксперты ВОЗ отметили конструктивной характер сотрудничества и дали положительную оценку системе Российской Федерации в области регулирования и контроля качества, эффективности и безопасности лекарственных средств. В соответствии с достигнутыми договоренностями Росздравнадзором совместно с заинтересованными ведомствами подготовлены материалы для последующей оценки российской регуляторной системы на соответствие требованиям ВОЗ.

Продолжается сотрудничество российских федеральных органов исполнительной власти с Международным советом по гармонизации технических требований к фармацевтическим препаратам для медицинского использования (ICH) в качестве наблюдателя. Специалисты Росздравнадзора, ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора и ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России активно работают в составе экспертных групп ICH, участвуя в обсуждении вопросов модернизации регуляторных практик и используя получаемый опыт для оперативного совершенствования деятельности по обеспечению граждан Российской Федерации качественными, эффективными и безопасными лекарственными средствами. Данная работа является одним из условий для дальнейшей подачи российской заявки на членство в ICH.
В рамках подачи заявки на членство Российской Федерации в Схеме сотрудничества фармацевтических инспекций (PIC/S) Росздравнадзор является контактной точкой в системе обмена быстрыми оповещениями по вопросам, возникшими из-за дефектов качества лекарственных препаратов (Rapid Alerts and Recalls Arising from Quality Defects). Указанный информационный обмен позволяет оперативно получать сведения о возможном обращении на территории Российской Федерации недоброкачественных или фальсифицированных лекарственных средств и принимать необходимые меры по их изъятию из оборота.
Продолжается работа Росздравнадзора по межрегиональным направлениям, что является необходимым условием успешной реализации любых проектов в фармацевтической отрасли.
В сентябре 2022 года Росздравнадзор принимал участие в Конференции Шанхайской организации сотрудничества (ШОС) по развитию медицинского и фармацевтического сотрудничества, организованной совместно Китайской Народной Республикой и Республикой Узбекистан.
Росздравнадзор совместно с Минздравом России и Минпромторгом России регулярно участвует в профильных мероприятиях стран БРИКС, в частности в консультациях по обсуждению проекта Меморандума о взаимопонимании и взаимодействию в области регулирования медицинской продукции между регуляторными органами стран БРИКС.
На регулярной основе продолжается взаимодействие и обмен информацией с зарубежными регуляторными органами в сфере контроля медицинской продукции и здравоохранения как по линии двусторонних Межправительственных комиссий, так и в рамках заключенных меморандумов о взаимопонимании.

В 2022 году в ходе переговоров с индийской стороной финализирована обновленная версия Меморандума о взаимопонимании между Росздравнадзором и Центральной организацией по контролю за стандартами лекарственных средств Министерства здравоохранения и благосостояния семьи (CDSCO). Подписание и последующая реализация документа позволят расширить двустороннее взаимодействие в области контроля качества, эффективности и безопасности лекарственных средств и в целом будут способствовать развитию российско-индийского сотрудничества в сфере здравоохранения. В рамках Меморандума о взаимопонимании между Росздравнадзором и Государственным управлением по контролю и регулированию лекарственных средств Китайской Народной Республики (NMPA) осуществляется информационный обмен о выявленных недоброкачественных лекарственных средствах.
Росздравнадзор принимает участие в формировании предусмотренных Договором о Евразийском экономическом союзе единых рынков товаров и услуг, а также реализации согласованных отраслевых политик. В частности, по вопросам, относящимся к компетенции ведомства, Росздравнадзор представляет интересы Российской Федерации в ходе заседаний рабочих групп по формированию общих подходов к регулированию обращения лекарственных средств в рамках Евразийского экономического союза.
Росздравнадзор участвует в работе над реализацией Плана мероприятий по повышению уровня обеспеченности государств-членов Евразийского экономического союза (ЕАЭС) стратегически важными лекарственными препаратами и фармацевтическими субстанциями для медицинского применения, производство которых должно быть обеспечено в Евразийском экономическом союзе до 2024 года, а также в обсуждении вопросов внедрения маркировки лекарственных препаратов средствами идентификации в целях обеспечения беспрепятственного оборота лекарственных препаратов при трансграничной торговле на территории ЕАЭС.
Российская Федерация с 1 января 2023 года стала председателем Евразийского экономического союза.
В связи с чем активизировано взаимодействие в рамках общих процессов Евразийского экономического союза в отношении лекарственных средств. Это межгосударственный обмен информацией между государствами-членами Евразийского экономического союза о фактах выявления незаконного оборота лекарственных средств, а также формирование Единой информационной базы данных по выявленным нежелательным реакциям (действиям) на лекарственные средства.
Заключение
Безопасные и эффективные лекарственные средства гарантированного качества имеют решающее значение для надлежащего функционирования системы здравоохранения.
Работа Росздравнадзора сфокусирована на предотвращении потенциального ущерба и угрозы здоровью населения путем обеспечения качества, эффективности и безопасности находящейся в обращении медицинской продукции, что неразрывно связано с изучением передового международного опыта, внедрением современных методик и практик в контрольную (надзорную) деятельность. Использование описанных в статье механизмов и инструментов позволяет оперативно анализировать поступающие сведения в целях предотвращения обращения на территории Российской Федерации лекарственных средств, не соответствующих установленным требованиям.
