ОБРАЩЕНИЕ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Изменения порядка ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации
1 — Федеральная служба по надзору в сфере здравоохранения, Российская Федерация, 109074, Москва, Славянская площадь, д. 4, стр. 1.
Статья посвящена вопросам ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации. Описан порядок процедуры ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации, вступивший в силу с 01.01.2021. Приведены разъяснения некоторых особенностей процедуры ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации.
Ключевые слова: медицинские изделия, ввоз медицинских изделий, разрешение на ввоз медицинских изделий, уведомление об отказе в выдаче разрешения на ввоз медицинских изделий, государственная услуга
С 1 января 2021 г. вступили в силу приказ Минздрава России от 30.06.2020 № 661н «Об утверждении порядка ввоза на территорию Российской Федерации медицинских изделий в целях государственной регистрации» и приказ Росздравнадзора от 30.11.2020 № 11205 «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по выдаче разрешений на ввоз на территорию Российской Федерации медицинских изделий в целях их государственной регистрации», которые регламентируют порядок ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации (далее – ввоз медицинских изделий). Вследствие этого признаны утратившими силу приказ Минздрава России от 15.06.2012 № 7н «Об утверждении Порядка ввоза на территорию Российской Федерации медицинских изделий в целях государственной регистрации» и приказ Минздрава России от 25.03.2016 № 184н «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по выдаче разрешений на ввоз на территорию Российской Федерации медицинских изделий в целях их государственной регистрации».
Основным изменением государственной услуги по выдаче разрешений на ввоз медицинских изделий является полный перевод услуги в электронный формат. Подача заявителем комплекта документов для получения разрешений на ввоз медицинских изделий, рассмотрение представленного комплекта документов и предоставление заявителю разрешения на ввоз медицинских изделий или уведомления об отказе в выдаче разрешения на ввоз медицинских изделий осуществляются посредством электронных документов и информационных систем: Единого портала государственных услуг (далее – ЕПГУ) и автоматизированной информационной системы Федеральной службы но надзору в сфере здравоохранения (далее – Росздравнадзор, АИС Росздравнадзора).
Заявитель путем использования личного кабинета на ЕПГУ заполняет заявление о выдаче разрешения на ввоз, прикладывает копии договоров на проведение необходимых испытаний (исследований) и копию документа, подтверждающего полномочия уполномоченного представителя производителя, и направляет данный комплект документов в адрес Росздравнадзора.
Под необходимыми испытаниями (исследованиями) понимаются технические испытания, токсикологические исследования, клинические испытания, а также испытания в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений), требуемые для государственной регистрации, в том числе для внесения изменений в документы, содержащиеся в регистрационном досье на медицинское изделие.
Копия документа, подтверждающего полномочия уполномоченного представителя производителя, не входит в подаваемый комплект документов, если производителем медицинского изделия, место производства которого находится на территории иностранного государства, является юридическое лицо или индивидуальный предприниматель, зарегистрированные на территории Российской Федерации.
Направленный комплект документов поступает в АИС Росздравнадзора, рассматривается ответственным исполнителем, затем подготавливается решение о выдаче разрешения на ввоз медицинских изделий или об отказе в выдаче разрешения на ввоз медицинских изделий. Разрешение на ввоз медицинских изделий или уведомление об отказе в выдаче разрешения на ввоз медицинских изделий в форме электронного документа, подписанного усиленной квалифицированной электронной подписью, направляется в личный кабинет на ЕПГУ и указанную в заявлении электронную почту заявителя. Разрешения на ввоз медицинских изделий также размещаются в электронном сервисе «Информация о выданных разрешениях Росздравнадзора о ввозе медицинских изделий на территорию Российской Федерации» на официальном сайте Росздравнадзора.
Считаем важным остановиться на особенностях требований, предъявляемых к договорам на проведение необходимых испытаний (исследований) и документам, подтверждающим полномочия уполномоченного представителя производителя.
Договоры на проведение технических испытаний, токсикологических исследований, а также испытаний в целях утверждения типа средств измерений должны быть заключены с испытательными организациями, аккредитованными Федеральной службой по аккредитации. Клинические испытания должны проводиться медицинскими организациями, которые соответствуют требованиям, установленным приказом Минздрава России от 16.05.2013 № 300н «Об утверждении требований к медицинским организациям, проводящим клинические испытания медицинских изделий, и порядка установления соответствия медицинских организаций этим требованиям». Перечень медицинских организаций, которые имеют право на проведение клинических и клинико-лабораторных испытаний, опубликован в электронном сервисе «Перечень медицинских организаций, проводящих клинические испытания медицинских изделий» на официальном сайте Росздравнадзора.
Копия документа, подтверждающего полномочия уполномоченного представителя производителя, должна представляться с заверенным в установленном порядке переводом на русский язык согласно ст. 81 «Основ законодательства Российской Федерации о нотариате» от 11.02.1993 № 4462-1. Нотариус свидетельствует верность перевода с одного языка на другой, если владеет соответствующими языками. Если нотариус не владеет соответствующими языками, перевод может быть сделан переводчиком, подлинность подписи которого свидетельствует нотариус.
В свою очередь, существуют особые требования к легализации документов в зависимости от страны происхождения медицинского изделия. Согласно ст. 37 Федерального закона от 05.07.2010 № 154-ФЗ «Консульский устав Российской Федерации» официальные документы, предназначенные для представления на территории Российской Федерации, составленные с участием должностных лиц компетентных органов государства пребывания или от них исходящие, должны быть легализованы консульским должностным лицом, если иное не предусмотрено международными договорами, участниками которых являются Российская Федерация и государство пребывания. К таким международным договорам относятся «Конвенция, отменяющая требование легализации иностранных официальных документов» (заключена в г. Гааге 05.10.1961) и «Конвенция о правовой помощи и правовых отношениях по гражданским, семейным и уголовным делам» (заключена в г. Минске 22.01.1993).
Также обращаем внимание, что в соответствии с п. 10 Постановления Правительства Российской Федерации от 03.04.2020 № 430 «Об особенностях обращения медицинских изделий, в том числе государственной регистрации серии (партии) медицинского изделия» (далее – Постановление № 430) допускается ввоз в Российскую Федерацию без получения разрешения Росздравнадзора незарегистрированных медицинских изделий по Перечню медицинских изделий, которые предназначены для применения в условиях военных действий, чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов, предусмотренному Приложением 1 к Постановлению № 430. При этом в течение трех рабочих дней со дня ввоза в Российскую Федерацию незарегистрированных медицинских изделий необходимо представить сведения о ввезенных сериях (партиях) медицинских изделий посредством автоматизированной системы «Сведения о медицинских изделиях, подаваемые в соответствии с Постановлением Правительства Российской Федерации от 03.04.2020 № 430» на официальном сайте Росздравнадзора.
Необходимо подчеркнуть, что процедура выдачи разрешений на ввоз медицинских изделий установлена только национальным законодательством Российской Федерации, а порядок ввоза медицинских изделий на территорию государств – членов Евразийского экономического союза не регламентирован.
Государственная услуга на получение разрешения на ввоз медицинских изделий с каждым годом становится более востребованной. После перевода государственной услуги полностью в электронный формат в 2021 г. наблюдается значительное увеличение количества подаваемых заявлений о выдаче разрешения на ввоз медицинских изделий (рис. 1).
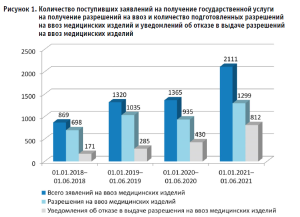
С другой стороны, качество подготовки комплектов документов, подаваемых для получения разрешений на ввоз медицинских изделий, все еще недостаточно высокое, что на фоне увеличившегося количества заявлений приводит к относительно большему количеству отказов в выдаче разрешений на ввоз медицинских изделий (рис. 2).

Таким образом, изменения порядка ввоза медицинских изделий в целях их государственной регистрации в части широкого использования информационных технологий позволяет модернизировать предоставление государственной услуги, сделать ее проще и удобнее для получения без потери качества проверки предоставляемых комплектов документов.
Надеемся, что широкое освещение вопроса о порядке ввоза медицинских изделий на территорию Российской Федерации в целях их государственной регистрации, в том числе в данной статье и в рамках конференции ФармМедОбращение 2021, поможет субъектам обращения медицинских изделий оптимизировать свою деятельность в данном направлении. Также на официальном сайте Росздравнадзора www.roszdravnadzor.gov.ru в подразделе «Медицинские изделия» «Ввоз медицинских изделий в целях их государственной регистрации» опубликованы методические указания «Типичные ошибки при подаче документов для получения разрешений на ввоз медицинских изделий в целях их государственной регистрации».
