ИННОВАЦИОННЫЕ МЕДИЦИНСКИЕ ИЗДЕЛИЯ
Инновационные имплантируемые изделия: путь от концепта к ежедневной клинической практике (опыт НМИЦ им. академика Е.Н. Мешалкина Минздрава России)
1 — ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России, 630055, Российская Федерация, г. Новосибирск, ул. Речкуновская, д. 15.
ORCID: https://orcid.org/0000-0002-1935-4170
2 — ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России, 630055, Российская Федерация, г. Новосибирск, ул. Речкуновская, д. 15.
ORCID: https://orcid.org/0000-0003-4625-4631
3 — ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России, 630055, Российская Федерация, г. Новосибирск, ул. Речкуновская, д. 15.
4 — ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России, 630055, Российская Федерация, г. Новосибирск, ул. Речкуновская, д. 15.
ORCID: https://orcid.org/0000-0002-5902-1442
5 — ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России, 630055, Российская Федерация, г. Новосибирск, ул. Речкуновская, д. 15.
ORCID: https://orcid.org/0000-0001-5417-6624
6 — ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России, 630055, Российская Федерация, г. Новосибирск, ул. Речкуновская, д. 15.
ORCID: https://orcid.org/0000-0001-9818-8678
В статье обсуждается практика разработки инновационных имплантируемых изделий для сердечно-сосудистой хирургии, сложившаяся в Национальном медицинском исследовательском центре им. академика Е.Н. Мешалкина Минздрава России. Показаны этапы разработки в соответствии с требованиями ГОСТ Р ИСО 13485-2017, а также источники финансирования каждого этапа. Приведена функциональная схема взаимодействия с индустриальным партнером в рамках проекта (грант Министерства промышленности и торговли РФ) по выведению на отечественный рынок четырех высокотехнологичных имплантируемых изделий – кардио-васкулярных протезов для транскатетерной и гибридной имплантации. Кратко освещены проблемы современной медицинской промышленности на пути к технологическому суверенитету, предложены меры для их преодоления.
Ключевые слова: инновационные разработки, кардио-васкулярные протезы, медицинская промышленность, технологический суверенитет, индустриальный партнер
Введение
Тяжелая ситуация, сложившаяся в биомедицинской науке Российской Федерации в 90-е годы прошлого века после распада Советского Союза, закономерно привела к утрате позиций, занимаемых ранее отечественной медицинской промышленностью. Это наиболее чувствительно затронуло самые высокотехнологичные области здравоохранения, одной из которых является сердечно-сосудистая хирургия. Если до 1970–80-х годов советская медицинская промышленность как-то справлялась с обеспечением клиник аппаратами искусственного кровообращения и искусственной вентиляции легких, протезами клапанов сердца и кровеносных сосудов и т.д. [1], то к началу 2000-х российский рынок высокотехнологичной аппаратуры и расходных материалов почти на 100% заняли зарубежные производители [2].
Это отрицательно сказалось на развитии прогрессивных кардиохирургических технологий, так как цена импортных инновационных изделий не позволяет свободное их использование в рамках среднего размера федеральной квоты на кардиохирургические вмешательства. Это, с одной стороны, ограничивает доступность высокотехнологичной кардиохирургической помощи для населения вследствие высокой стоимости хирургических вмешательств, а с другой – замедляет внедрение наиболее современных инновационных разработок. Так, если первый транскатетерный аортальный клапан был имплантирован во Франции в 2002 г., то в России – в 2009 г. [3]. В настоящее время количество таких вмешательств в странах Запада ежегодно исчисляется десятками тысяч, тогда как в РФ выполняется менее полутора тысяч [4-6], хотя потребность в них значительно выше. Так, на сегодняшний день очередь на транскатетерное протезирование аортального клапана в нашем Центре составляет более 1 года.
Несмотря на все вышесказанное, российское здравоохранение до последнего времени продолжало пребывать в парадигме «импортировать дешевле и легче, чем разрабатывать и внедрять». Однако с 2022 г., в условиях введения и усиливающегося санкционного давления со стороны технологически развитых стран, все более очевидной становится необходимость развития и государственной финансовой поддержки биомедицинских исследований, ориентированных на создание и доведение до клинического внедрения инновационных медицинских изделий, будь то аппаратура или расходные материалы.
Цель работы
Анализ авторского опыта разработки и внедрения инновационных имплантируемых изделий (кардио-васкулярных протезов), который может быть полезным для научных учреждений, занятых аналогичной деятельностью.
Этапность прикладной инновационной разработки
- Создание и патентование концепта. Каждый новый проект начинается с создания мультидисциплинарной команды и изучения новейшей мировой литературы в данной области исследований. В нашем Центре инициаторами зачастую являются специалисты кардиохирургического либо рентгенхирургического профиля, хорошо знакомые на практике с самыми современными импортными изделиями, их достоинствами и недостатками. Они же в дальнейшем верифицируют каждый этап разработки в соответствии с пунктом 7.3 ГОСТ Р ИСО 13485-2017 [7]. Специалисты в области трансляционной медицины разрабатывают концепт имплантируемого изделия, исходя из задачи сохранить достоинства и нивелировать недостатки известных на сегодняшний день моделей.
На примере разработанного нами биопротеза аортального клапана двойного назначения можно проследить все этапы разработки (рис.1). Данный биопротез отличается от всех известных тем, что может быть имплантирован не только транскатетерным доступом (транссосудистым через бедренную или сонную артерию, трансапикальным транскатетерным), но и открытым (мини-инвазивным) бесшовным способом [8]. Все известные на сегодняшний день клапаны предназначены либо для открытой бесшовной, либо для транскатетерной имплантации. Это связано с конструктивными особенностями основных зон крепления известных моделей [9].
Нами был разработан концепт самораскрывающегося биопротеза, имеющего 4 зоны крепления в разных участках корня аорты: выводном отделе левого желудочка, фиброзном кольце аортального клапана пациента, проксимальной части синусов Вальсальвы, а также в их дистальной части над устьями коронарных артерий (рис. 1.1). Поскольку данный концепт отличается оригинальностью, нами была подана заявка и получен патент на изобретение.
Патентование разработки мы считаем необходимым, так как это облегчает дальнейшее взаимодействие с реальным сектором экономики: наиболее эффективным и не несущим потенциальных конфликтов следует признать заключение лицензионного договора с предприятием медицинской промышленности при передаче изделия на серийное производство с последующей выплатой роялти государственной организации-разработчику.
- Численное моделирование зоны реконструкции. Данный этап (рис. 1.2–1.4) является обязательным при разработке имплантируемых устройств для сердечно-сосудистой хирургии, так как позволяет избежать многочисленных итераций в дорогостоящих экспериментах на животных, которые, кроме всего прочего, не всегда позволяют полностью воссоздать условия функционирования имплантата в организме пациента. Так, например, наиболее критичным для корня аорты является выраженное различие подвижности элементов корня при работе в «здоровой», эластичной анатомической зоне у животного и в «ригидном» корне пациента при дегенеративном стенозе аортального клапана.
Входными данными для моделирования являются результаты, полученные с использованием компьютерной томографии и/ или магнитно-резонансной томографии на достаточно большом количестве пациентов (по нашему опыту – не менее 250 человек) с той или иной патологией. Группа должна включать все анатомические варианты патологии, для реконструкции которой предназначен данный протез, в количестве, позволяющем выполнить статистическую обработку размеров с минимальными погрешностями. Перед специалистами лучевой диагностики ставится задача количественной характеристики отдельных элементов анатомической зоны, а именно – их размеров и подвижности [10].
На основании входных данных специалисты по биотехническому проектированию строят математические модели зоны реконструкции в различных типоразмерных вариантах, финализируя их методом аддитивной 3D-печати для верификации данного этапа хирургами.
- Биотехническое проектирование имплантируемого изделия. В нашем случае биотехническое проектирование включало «подгонку» размеров концепта под реальные размеры элементов анатомической зоны (рис. 1.5–1.6). Кроме того, были рассчитаны параметры самораскрывающегося каркаса для создания необходимых и достаточных радиальных сил в зонах крепления.
Верификацию данного этапа разработки осуществляли также in silico, на моделях корня аорты и каркаса с заданными характеристиками.
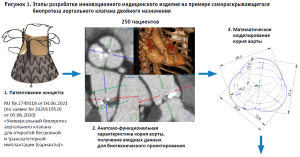
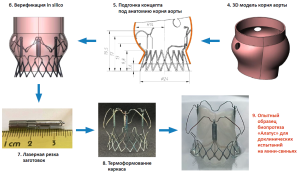
- Реализация опытных образцов. Наши последние проекты связаны с протезами на самораскрывающихся нитиноловых каркасах. Это соответствует мировому тренду, поскольку «умные материалы» на основе никелида титана способны изменять свою форму за счет фазовых переходов при изменении температур в заданных диапазонах. Каркасы сложной формы, изготовленные на основе нитиноловой трубки, во время упаковки в доставочную систему при температуре около 0 оС легко сжимаются до исходного диаметра трубки. Таким образом, для изготовления каркаса достаточно вырезать из нитиноловой трубки заготовку (рис. 1.7) и при определенном температурном режиме придать каркасу нужную форму (рис. 1.8). Далее к каркасу фиксируют створчатый аппарат, который может состоять как из консервированных тканей животного происхождения, так и из биорезорбируемых или нерезорбируемых полимеров (рис. 1.9). В настоящее время мы используем для этих целей перикард свиньи или крупного рогатого скота, консервированный диэпоксидом.
- Доклинические испытания опытных образцов in vitro. Опытные образцы должны быть протестированы, в первую очередь, на соответствие характеристик требованиям стандартов на каждый вид продукции. Для клапанных биопротезов это ГОСТ 31618-2012, для сосудистых – ГОСТ Р ИСО 7198-2013 и ГОСТ Р ИСО 25539-2012 [11–13].
При этом нужно отметить, что стандарты, регламентирующие требования к сосудистым протезам, гармонизированы с международными, в то время как в РФ отсутствует стандарт для протезов клапанов сердца, имплантируемых транскатетерно. Таким образом, при тестировании клапанных биопротезов мы добровольно прибегаем к использованию ISO 5840:3-2021 [14]. Из всего объема критических тестов, представленных на рисунке 2, ГОСТ 31618-2012 регламентирует лишь испытания в стенде пульсирующего потока жидкости.
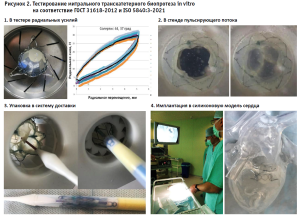
- Доклинические испытания опытных образцов in vivo. Данный этап соответствует последней фазе доклинических испытаний и должен быть выполнен на адекватной животной модели со сроками отдаленного наблюдения 6 месяцев, что регламентировано ГОСТ Р ИСО 7198-2013 и ГОСТ Р ИСО 25539-2012, а также ISO 5840:3-2021, но отсутствует в ГОСТ 31618-2012.
Мы считаем данный этап обязательным также для транскатетерных клапанных биопротезов, так как он является финальной верификацией разработки перед началом клинических испытаний и позволяет выявить те недостатки функционирования комплексного устройства «клапан + система доставки», которые не могут быть идентифицированы в экспериментах in vitro.
Наибольшей сложностью этого этапа является правильный выбор крупного животного для проведения экспериментов. Так, например, мы убедились в невозможности тестировать транскатетерные митральные биопротезы на свиньях в связи с выраженными различиями в строении левого желудочка (гипертрофия миокарда и маленькая полость ЛЖ, тогда как конструкция клапана предполагает его имплантацию в дилатированные левые отделы сердца).
В связи с этим мы считаем необходимым не только предварительное тщательное изучение анатомической зоны закрепления протеза у данного вида животных с помощью лучевых методов диагностики, но и контрольное предоперационное ЭХО-кардиографическое исследование каждого животного (рис. 3А).
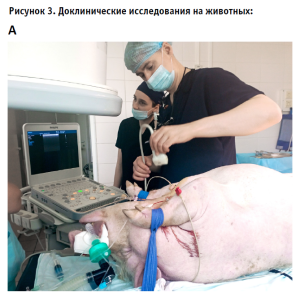
Если результаты полугодового наблюдения, включающие, помимо клинических и лабораторных критериев, ЭХО-кардиографическую оценку структуры и функции протеза, а также окружающих анатомических структур, оказываются удовлетворительными, мы делаем предварительный вывод об эффективности и безопасности имплантируемого медицинского изделия и начинаем его регистрацию.
На данном этапе появляется необходимость наиболее плотного контакта с индустриальным партнером (Ип), хотя Ип должен включаться в процесс еще на этапе планирования прикладной разработки.
Взаимодействие с индустриальным партнером
На этапе планирования необходимо отчетливо представлять себе ряд аспектов, обусловливающих целесообразность разработки конкретного инновационного продукта. И в этом отношении ведущая роль принадлежит индустриальным партнерам, которым предстоит не только производить, но и реализовывать данный продукт.
Необходим, во-первых, тщательный анализ потенциального объема рынка и ориентация на его определенные географические сегменты. Эти вопросы должны быть проработаны специалистами Ип, с тем, чтобы последний мог правильно осуществлять свое бизнес-планирование по выведению инновационного продукта в реальный сектор экономики.
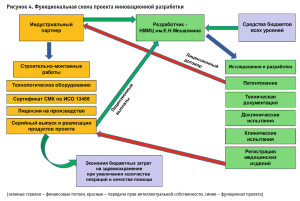
Обязательно должна быть согласована «функциональная структура» проекта (рис. 4) с четким распределением обязанностей и оформлением «дорожной карты» проекта. Индустриальный партнер должен быть информирован о результатах всех этапов разработки, чтобы планировать бюджет софинансирования и производственных затрат. К непосредственной подготовке производства необходимо приступать уже на этапе доклинических испытаний, с тем чтобы к моменту получения регистрационного удостоверения были введены дополнительные мощности (при необходимости), проведено обучение персонала приемам и методам работы с новым изделием, а также отработана логистика поставок и закуплено необходимое количество сырья и расходных материалов.
На этапе регистрации МИ взаимодействие с Ип становится наиболее плотным: заключается лицензионный договор на коммерческое использование патента, передача комплекта технической и эксплуатационной документации на МИ, отладка технологии производства. В свою очередь, Ип «встраивает» новый продукт в свою систему менеджмента качества, а также поддерживает ее в актуальном состоянии, что подтверждает наличием лицензии на производство, сертификата ИСО 13485, заключениями регулярных ресертификационных аудитов и инспекционной проверки комиссией Росздравнадзора (если таковая состоялась).
После получения регистрационного удостоверения и начала серийного выпуска инновационного продукта продолжается поддержание связи с индустриальным партнером: наиболее авторитетные в профессиональных кругах специалисты Центра публикуют свои экспериментальные и клинические результаты о применении нового МИ, организуют многоцентровые клинические исследования, проводят обучающие семинары и мастер-классы, оказывают консультативную помощь в организации выставочных экспозиций. Все это особенно важно для тех инновационных изделий, рынок которых не сформирован. В нашем случае это – транскатетерные биопротезы митрального клапана (рис. 5), которые пока не получили широкого распространения даже на рынках западных стран и находятся на этапе мультицентровых клинических испытаний.


Таким образом, «выведение в жизнь» инновационного медицинского изделия представляет собой циклический процесс: практические специалисты инициируют разработку и сопровождают ее до рутинного использования в клинике, взаимодействуя как с представителями фундаментальной и трансляционной медицины, так и с индустриальными партнерами. Это позволяет снизить научно-технические и производственно-технологические риски проекта.
Финансирование инновационных разработок
Мы считаем правильным этапное финансирование инновационных разработок. Поисковые исследования – от идеи до подтверждения ее жизнеспособности – финансируются из внебюджетных средств Центра. Эти средства выделяются на расходные материалы и выполнение отдельных исследований в сторонних организациях.
Если первоначальная гипотеза подтверждена и имеется определенный научный задел, подается заявка на конкурсное финансирование одним из государственных фондов – чаще всего, это Российский научный фонд (РНФ). При условии победы в конкурсе научный коллектив на средства гранта решает фундаментальные проблемы, которые сопровождают все без исключения прикладные инновационные разработки.
Эти два этапа могут быть объединены в рамках государственного задания, выдаваемого Центру Минздравом России. В любом случае, их результатом являются научные публикации, патенты, конструкторская документация и первые прототипы инновационного продукта.
Однако доведение прототипа до готового продукта, производимого серийно, зарегистрированного в Росздравнадзоре в установленном порядке и реализуемого на рынке, требует более серьезных финансовых вливаний и не может быть выполнено без государственной поддержки (грантов министерств и ведомств, федеральных целевых программ и т.д.). Безусловно, Ип, если он заинтересован в продукте, также оказывает финансовую помощь на различных этапах выполнения проекта (рис. 4). Кроме того, это участие является индикатором заинтересованности Ип в проекте и снижает риски того, что доведенная до финала разработка не будет востребована.
В настоящее время мы выполняем грант Министерства промышленности и торговли (конкурс 2021 г.), в рамках которого должны состояться регистрация и выведение на рынок четырех имплантируемых изделий для выполнения высокотехнологичных кардиохирургических вмешательств (рис. 5): клапан-содержащего кондуита для операций при врожденных пороках сердца у детей, гибридного протеза грудной аорты, транскатетерных биопротезов митрального и аортального клапанов. Все изделия защищены патентами РФ на изобретения [8, 15–17].
Целесообразность бюджетного финансирования прикладных разработок обусловлена тем, что в результате отечественное здравоохранение получает высокотехнологичное МИ по гораздо более низкой цене, нежели импортные аналоги. Это происходит за счет уменьшения цепочки поставщиков, снижения инвестиционной нагрузки на производителя и относительно низкой стоимости отечественных научно-технических процессов. Так, согласно бизнес-плану нашего проекта, совокупные вложения должны полностью окупиться в течение первых пяти лет при цене изделий, укладывающихся в размер федеральной квоты на кардиохирургические вмешательства. Все это способствует повышению доступности высокотехнологичной помощи населению.
Заключение
Необходимо обозначить одну из главных современных проблем внедрения инновационных разработок – недостаточную развитость в нашей стране высоких технологий в смежных областях промышленности при резком ограничении доступа к высокотехнологичным комплектующим и услугам в Европе, обусловленном санкциями. Так, например, на внедрение нашего проекта оказывает существенное негативное влияние отсутствие:
отечественного производства качественных трубок из нитинола медицинской марки. Продолжаем импортировать данное сырье, но уже не из Германии, а из Китая, со значительной потерей качества;
предприятий, выполняющих лазерную резку нитинола для медицинских целей. Отечественное станкостроение не выпускает таких станков, доступ к европейской технике отсутствует, поэтому станок для лазерной резки также закупили в Китае. Все это сопряжено со значительной сложностью поиска поставщиков на азиатских рынках;
предприятий, занимающихся термообработкой медицинского нитинола для придания ему сложных форм и необходимой температуры фазового перехода. Во всем мире эти технологии охраняются в режиме ноу-хау, поэтому приходится разрабатывать их самостоятельно, «с нуля», что увеличивает длительность выполнения отдельных этапов проекта и обусловливает необходимость освоения компетенций, выходящих за рамки биомедицинских исследований.
Сложность ситуации усугубляется задачей быстрого импортозамещения и, более того, достижения технологического суверенитета. Эта задача труднодостижима вследствие традиционной разобщенности разработчиков и производителей высокотехнологичных МИ и, без сомнения, требует усиления мер государственной поддержки. Так, безусловно положительной мерой явилось продление действия национальной системы регистрации МИ до 2025 г. Мы считаем, однако, что с целью насыщения высокотехнологичными МИ внутреннего рынка данная система должна быть продлена, как минимум, до 2030 г. Это значительно ускорит выведение на рынок новой продукции, по сравнению с требованием обязательной регистрации по системе ЕвразЭС.
Кроме того, положительную роль могла бы сыграть передача региональным подразделениям Росздравнадзора права на выдачу лицензии предприятиям медицинской промышленности.
С нашей точки зрения, необходима также переориентация отечественных научных фондов на прикладные продуктоориентированные разработки сроком хотя бы на пять лет, а также увеличение размеров грантовой поддержки на этапе внедрения МИ.
Необходимо повысить эффективность программы субсидирования регионами компаний, наладивших инновационное производство, возможно, выделив в ней отдельной строкой высокотехнологичные производства МИ. Создание таких производств требует больших вложений, но окупается не быстро за счет довольно длительного периода испытаний и регистрации новой продукции, в связи с чем не очень популярно у частных инвесторов.
Таким образом, задача достижения технологического суверенитета в области медицинской промышленности является выполнимой, однако требует объединенных усилий науки, бизнеса и государства.
- Затравкин С.Н., Вишленкова Е.А., Чалова В.В. Состояние и возможности советского здравоохранения в 1960—1980-х годах. Проблемы социальной гигиены, здравоохранения и истории медицины. 2021; 29(1): 153–160. doi:10.32687/0869-866X-2020-29-1-153-160.
- Воронин Ю.М. О состоянии медицинского оборудования и использовании средств федерального бюджета и внебюджетных источников, направляемых на его производство и закупку (Аналитический доклад). // Счетная палата, 30.05.2003 [сайт]. URL: https://ach.gov.ru/checks/o-sostoyanii-meditsinskogooborudovaniya-i-ispolzovanii-sredstv-federalnogo-byudzheta-ivnebyudzhetn (дата обращения: 31.08.2023).
- Бокерия Л.А., Алекян Б.Г., Пурсанов М.Г., Мироненко В.А., Бокерия О.Л., Макаренко В.Н. и др. Транскатетерная имплантация аортального клапана: первый опыт в России. Грудная и сердечно-сосудистая хирургия. 2011; (2): 4–10.
- Gaede L., Blumenstein J., Husser O., Liebetrau C., D rr O., Grothusen C., Eckel C., Al-Terki H., Kim W.K., Nef H., Tesche C., Hamm C.W., Els sser A., Achenbach S., M llmann H. Aortic valve replacement in Germany in 2019. Clin. Res. Cardiol. 2021; 110(3): 460–465. doi: 10.1007/s00392-020-01788-6.
- Alkhouli M., Alqahtani F., Ziada K.M., Aljohani S., Holmes D.R., Mathew V. Contemporary trends in the management of aortic stenosis in the USA. Eur. Heart J. 2020; 41(8): 921–928. doi: 10.1093/eurheartj/ehz568.
- Джидзалова Д.Х., Бердибеков Б.Ш., Петросян К.В. Транскатетерная имплантация аортального клапана: от ранее неоперабельных больных до пациентов низкого хирургического риска. Креативная кардиология. 2021; 15 (4): 440–55. doi: 10.24022/1997-3187-2021-15-4-440-455.
- ГОСТ Р ИСО 13485-2017 Изделия медицинские. Системы менеджмента качества. Требования для целей регулирования. – М.: Стандартинформ, 2018. – 34 с.
- Патент RU № 2749118 (по заявке № 2020119520 от 05.06.2020) «Универсальный биопротез аортального клапана для открытой бесшовной и транскатетерной имплантации (варианты)».
- Leone P.P., Scotti A., Ho E.C., Assafin M., Doolittle J., Chau M., Slipczuk L., Levitus M., Regazzoli D., Mangieri A., Latib A. Prosthesis Tailoring for Patients Undergoing Transcatheter Aortic Valve Implantation. J Clin Med. 2023; 12(1): 338. doi: 10.3390/jcm12010338.
- Кобелев Е., Берген Т.А., Таркова А.Р., Крестьянинов О.В., Бобрикова Е.Э., Сафро И.К., Чернявский А.М., Журавлева И.Ю. Новый взгляд на структурные изменения корня аорты при стенозе аортального клапана. Современные технологии в медицине. 2022; 14(2): 51–57. doi:10.17691/stm2022.14.2.05.
- ГОСТ 31618.1-2012 Протезы клапанов сердца. Часть 1. Общие технические требования и методы испытаний – М.: Стандартинформ, 2013. – 22 с.
- ГОСТ Р ИСО 7198-2013 Имплантаты для сердечно-сосудистой системы. Трубчатые сосудистые протезы. – М.: Стандартинформ, 2014. – 39 с.
- ГОСТ Р ИСО 25539-1-2012 Имплантаты сердечно-сосудистые. Внутрисосудистые имплантаты. Часть 1. Эндоваскулярные протезы. – М.: Стандартинформ, 2014. – 67 с.
- ISO 5840-3:2021 Cardiovascular implants – Cardiac valve prostheses – Part 3: Heart valve substitutes implanted by transcatheter techniques. – International Standard Organization, 2021. – 57 p.
- № 2633544 «Способ изготовления клапан-содержащего кондуита из яремной вены крупного рогатого скота» (по заявке № 2016122308, от 06.06.2016).
- № 2738306 «Биопротез для транскатетерной замены митрального клапана» (по заявке № 2020119522, от 05.06.2020).
- № 2754769 (по заявке № 2020136065 от 03.11.2020) «Комбинированный гибридный протез с бесшовными соединениями для протезирования грудной аорты и ее ветвей (варианты) и способ его имплантации (варианты)».
