ДЕЯТЕЛЬНОСТЬ ПОДВЕДОМСТВЕННЫХ ОРГАНИЗАЦИЙ РОСЗДРАВНАДЗОРА
ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора: совершенствование возможностей лабораторных комплексов – гарантия эффективности контроля качества лекарственных средств
1 — ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4, стр.1.
Лекарственные препараты — сложный объект экспертизы, качественная и количественная характеристика их состава определяет фармакотерапевтическое воздействие на организм человека. Задачей лабораторной экспертизы является определение качества лекарственного препарата на соответствие его фармакопейному и заявленному производителем стандарту. Фактически от результатов экспертизы зависит, получит ли потребитель доступ к необходимым ему эффективным и качественным лекарственным препаратам. В Российской Федерации выполнение испытаний качества лекарственных средств в рамках государственного контроля возложено на Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, в состав которого входят современные лабораторные комплексы по контролю качества лекарственных средств.
Ключевые слова: мониторинг качества лекарственных средств, лабораторные комплексы по контролю качества лекарственных средств, передвижные лаборатории, Интегрированная информационная лабораторная система, экспресс-анализ качества лекарственных препаратов, скрининг качества лекарственных препаратов неразрушающими методами
Одной из важнейших задач государства является охрана здоровья его граждан. Оказание надлежащей медицинской помощи невозможно без эффективных, безопасных и качественных лекарственных препаратов. Защита фармацевтического рынка и всех его участников от некачественной и поэтому опасной продукции достигается посредством постоянного мониторинга качества лекарственных препаратов. Одним из обязательных компонентов эффективной государственной системы контроля качества лекарственных средств является наличие федеральных лабораторий. В Российской Федерации выполнение испытаний качества лекарственных средств в рамках государственного контроля возложено на Федеральное государственное бюджетное учреждение «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения (далее – ФГБУ «ИМЦЭУАОСМП» Росздравнадзора), которое объединяет в своей структуре 13 лабораторных комплексов по контролю качества лекарственных средств, расположенных во всех федеральных округах (рис. 1).
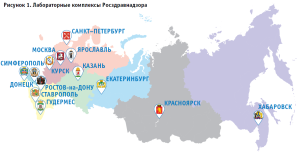
Функции по созданию и содержанию лабораторий контроля качества лекарственных средств были возложены на ФГБУ «ИМЦЭУАОСМП» Росздравнадзора в соответствии с Распоряжением Правительства РФ №1316-р от 04.08.10. В 2010–2012 годах введены в эксплуатацию лабораторные комплексы в городах: Санкт-Петербург, Ростов-на-Дону, Екатеринбург, Хабаровск, Красноярск, Гудермес, Казань. В 2013 году введен в эксплуатацию лабораторный комплекс в Москве. После воссоединения Крыма с Российской Федерацией в 2014 году начал свою работу новый лабораторный комплекс в городе Симферополе. В 2021 году в рамках реализации федеральной целевой программы «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» и во исполнение п. 6 перечня поручений Президента Российской Федерации В.В. Путина от 30.04.2016 № Пр-812 о развитии федеральных лабораторий по контролю качества лекарственных средств создан новый, самый мощный и современный лабораторный комплекс в городе Ярославле.
В целях приведения к российским стандартам системы контроля качества лекарственных средств в новых регионах, вошедших в состав Российской Федерации, в 2023 году создан лабораторный комплекс в городе Донецке.
Основополагающими принципами деятельности лабораторных комплексов ФГБУ «ИМЦЭУАОСМП» Росздравнадзора являются:
- объективность и независимость экспертных оценок;
- наличие единой системы экспертизы качества, построенной на введении единых стандартных операционных процедур;
- использование основных норм и процедур, гармонизированных с международными стандартами;
- прозрачность деятельности;
- ответственность по обязательствам.
Лабораторные комплексы ФГБУ «ИМЦЭУАОСМП» Росздравнадзора являются в настоящее время одними из самых оснащенных центров испытаний качества лекарственных препаратов в Российской Федерации. Материально-технические базы центров регулярно обновляются в соответствии с требованиями как российской, так и зарубежных фармакопей. Фактически от результатов экспертизы зависит, получит ли потребитель доступ к необходимым ему эффективным и качественным лекарственным препаратам.
Лекарственные препараты являются сложным объектом экспертизы, качественная и количественная характеристика их состава определяет фармакотерапевтическое воздействие на организм человека. Поэтому задачей лабораторной экспертизы является определение качества лекарственного препарата на соответствие его фармакопейному и заявленному производителем стандарту.
Количество выполняемых лабораторными комплексами ФГБУ «ИМЦЭУАОСМП» Росздравнадзора экспертиз качества лекарственных средств в рамках государственного контроля ежегодно растет и в настоящее время составляет более 40 тыс. экспертиз в год.
В лабораторных комплексах ФГБУ «ИМЦЭУАОСМП» Росздравнадзора на единой методологической основе разработана, внедрена и поддерживается в рабочем состоянии система менеджмента качества на соответствие стандарта ИСО/МЭК 17025:2019 «Общие требования к компетентности испытательных и калибровочных лабораторий», что ежегодно подтверждается наличием аттестатов национального и международных органов по аккредитации. В частности, лабораторный комплекс в Ростове-на-Дону имеет преквалификацию ВОЗ на соответствие требованиям надлежащей практики ВОЗ для лабораторий, осуществляющих контроль качества фармацевтической продукции, лабораторный комплекс в Красноярске является ассоциированным членом контрольных лабораторий (OMCL) Европейского Директората по качеству.
Лабораторным комплексам в Ростове-на-Дону, Санкт-Петербурге и Красноярске присвоен статус соответствия принципам надлежащей лабораторной практики (GLP) ОЭСР в национальной системе аккредитации, что позволяет выполнять доклинические исследования лекарственных средств.

В 2022 году в целях проведения испытаний качества в рамках технической помощи российским производителям лабораторные комплексы ФГБУ «ИМЦЭУАОСМП» Росздравнадзора получили лицензии на производство лекарственных средств для медицинского применения (Л012-00102-77/00330817 от 30.05.2022 г.)
Это позволило минимизировать издержки при проведении испытаний качества производимых фармацевтическими предприятиями лекарственных средств.
В целях оптимизации процесса экспертизы качества каждый лабораторный комплекс имеет свою специализацию (рис. 2). Особую роль в проведении контроля качества лекарственных средств имеет оценка качества иммунобиологических препаратов.
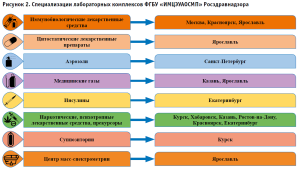
Иммунобиологические лаборатории ФГБУ «ИМЦЭУАОСМП» организованы в трех лабораторных комплексах в городах Москва, Красноярск, Ярославль. Оценка экспертизы качества иммунобиологических лекарственных препаратов и анализ сводных протоколов в рамках ввода в гражданский оборот проводится в Центре экспертизы и развития методов контроля качества иммунобиологических препаратов ФГБУ «ИМЦЭУАОСМ» Росздравнадзора.
Анализ трендов, проводимый Центром экспертизы и развития методов контроля качества иммунобиологических препаратов ФГБУ «ИМЦЭУАОСМ» Росздравнадзора, позволяет оценить стабильность производственного процесса.
Разработка и внедрение новых методов испытаний качества лекарственных средств, в том числе без вскрытия упаковки, а также анализ кислорода медицинского и других медицинских газов являются наиболее перспективными направлениями. Методы позволяют проводить экспресс-анализ качества лекарственных препаратов непосредственно на фармацевтическом складе, в медицинской или аптечной организации. Применение экспресс-анализа существенно снижает издержки участников фармацевтического рынка и одновременно позволяет увеличить объем контроля за счет снижения стоимости исследования и сокращения временных затрат. Применение отечественного оборудования, собственных запатентованных разработок и баз данных обеспечивает полную независимость от импортных решений. Для проведения скрининга качества лекарственных препаратов неразрушающими методами в лабораторных комплексах функционируют передвижные лаборатории, оснащенные портативными газохроматографическими комплексами для контроля качества кислорода медицинского, рамановским и БИК-спектрометрами для неинвазивного контроля качества лекарственных средств.
Мобильные лаборатории комплектуются на базе грузопассажирского фургона путем его переоборудования в соответствии с унифицированными требованиями ФГБУ «ИМЦЭУАОСМП» Росздравнадзора и дооснащением аналитическим оборудованием.
В период пандемии COVID-19, когда использование кислорода медицинского для лечения пациентов стало жизненно необходимым и его потребление выросло более чем на 80%, единственным решением для оперативного контроля качества кислорода медицинского являлось проведение испытаний в передвижных лабораториях ФГБУ «ИМЦЭУАОСМП» Росздравнадзора непосредственно в медицинских учреждениях.
Для проведения испытаний лекарственных средств и фармацевтических субстанций с целью обнаружения и идентификации посторонних примесей как задекларированных в нормативной документации, так и незадекларированных, на базе Ярославского лабораторного комплекса ФГБУ «ИМЦЭУАОСМП» Росздравнадзора создан Центр масс-спектрометрического анализа. Центр оснащен уникальным оборудованием, позволяющим обнаруживать и идентифицировать примеси в следовых и ультраследовых концентрациях, и является единственным специализированным центром в Российской Федерации в данной сфере. В связи с интенсивным развитием лабораторных комплексов ФГБУ «ИМЦЭУАОСМП» Росздравнадзора крайне важными являются задачи по оперативному управлению огромным потоком информации в режиме «реального времени», автоматизированному сбору статистической и управленческой отчетности, срочному получению информации о результатах проведения испытаний качества. В целях создания единого информационного пространства для всех лабораторных комплексов ФГБУ «ИМЦЭУАОСМП» Росздравнадзора за 18 месяцев разработало Интегрированную информационную лабораторную систему (далее – ИИЛС), используя исключительно отечественные информационные решения. В настоящее время в ИИЛС ежедневно работает более 500 пользователей.
ИИЛС обеспечивает поддержку полного цикла лабораторных бизнес-процессов, начиная от поступления образца лекарственного средства до выдачи протоколов испытаний, включая полную прослеживаемость образца лекарственного средства в информационных потоках. ИИЛС обеспечивает управление испытаниями образцов, персоналом, оборудованием, складским учетом и отчетностью. ИИЛС интегрирована с Государственным реестром лекарственных средств, что позволяет автоматически получать справочные данные по лекарственным средствам, исключая ручной ввод. Одним из новшеств ИИЛС является автоматическое построение трендов, анализ которого позволяет оценить стабильность производственного процесса иммунобиологических лекарственных препаратов. В соответствии с международными требованиями ИИЛС на регулярной основе проходит валидацию.
В целях упрощения процедуры по вводу в гражданский оборот иммунобиологических лекарственных препаратов в 2023 году проведена интеграция ИИЛС с Государственной автоматизированной информационной системой Федеральной службы по надзору в сфере здравоохранения (АИС РЗН). Введен в промышленную эксплуатацию новый функционал по работе с заявителями, который позволяет без посещения испытательной лаборатории подавать заявки на испытания, отслеживать статус образца, получать в электронном виде протоколы испытаний, подписанные усиленной квалифицированной электронной подписью.
Информационная лабораторная система ФГБУ «ИМЦЭУАОСМП» Росздравнадзора неоднократно отмечалась как «Лучшее ИТ-решение для здравоохранения» на международных конгрессах по информационным технологиям в медицине.
В целях экспертной работы по организации и проведению фармаконадзора на базе ФГБУ «ИМЦЭУАОСМП» Росздравнадзора создан Центр фармаконадзора.
Центр осуществляет экспертную оценку сведений, поступающих в базу данных спонтанных сообщений о нежелательных реакциях лекарственных препаратов АИС Росздравнадзора, а также постоянный анализ периодической отчетности по фармаконадзору, поступающей в Росздравнадзор от держателей регистрационных удостоверений.
В рамках решения задач по подготовке кадров для фармацевтической отрасли в марте 2021 года руководством ФГБУ «ИМЦЭУАОСМП» Росздравнадзора и ректором Ярославского Государственного медицинского университета А.В. Павловым в присутствии министра здравоохранения РФ М.А. Мурашко и руководителя Федеральной службы по надзору в сфере здравоохранения А.В. Самойловой было подписано соглашение об организации базовой кафедры инновационной фармации на базе Ярославского лабораторного комплекса.
Важным направлением деятельности ФГБУ «ИМЦЭУАОСМП» Росздравнадзора также является участие в научно-практических конференциях, семинарах, взаимодействие с зарубежными профильными организациями в целях обмена опытом и расширения компетенций экспертов в области проведения испытаний качества лекарственных средств.
Предприятия фармацевтической отрасли постоянно создают новые, более эффективные лекарственные средства, направленные на борьбу с онкологическими и инфекционными заболеваниями, ВИЧ, гепатитом С, сахарным диабетом, коронавирусом и другими трудно излечимыми недугами.
Отечественные производители лекарственных средств внедряют инновационные технологии производства препаратов с использованием отечественных субстанций, планируют запуск производства изотопной продукции медицинского назначения, включая активные радиофармацевтические субстанции и радиофармацевтические лекарственные препараты. В связи с этим, перспективными направлениями развития ФГБУ «ИМЦЭУАОСМП» Росздравнадзора определены:
- внедрение и использование в лабораторных комплексах инновационных методов экспертизы качества лекарственных средств;
- внедрение методов аттестации клеточных и вирусных банков;
- развитие и совершенствование методов обнаружения и идентификации примесей;
- проведение исследовательских работ по изучению возможности использования нейронных сетей с целью переноса библиотеки спектров лекарственных препаратов между приборами различных производителей;
- поиск механизмов распознавания спектров в рамках проведения скрининга качества.
В целях проведения контроля качества радиофармацевтических лекарственных препаратов планируется создание на базе Ярославского лабораторного комплекса ФГБУ «ИМЦЭУАОСМП» Росздравнадзора радиохимической лаборатории.
Современный подход к контролю качества лекарственных средств, применяемый ФГБУ «ИМЦЭУАОСМП» Росздравнадзора, вносит значимый вклад в борьбу с недоброкачественными лекарственными средствами, способствует повышению безопасности лекарственных препаратов.
