МЕДИЦИНСКИЕ ИЗДЕЛИЯ
Безопасность медицинских изделий в условиях борьбы с пандемией COVID-19
1 — ФГБОУ ВО «Санкт-Петербургский государственный университет», 199034, Российская Федерация, г. Санкт-Петербург, Университетская набережная, д. 7/9.
ORCID: https://orcid.org/0000-0002-7765-4876
2 — ФГБОУ ВО «Санкт-Петербургский государственный университет», 199034, Российская Федерация, г. Санкт-Петербург, Университетская набережная, д. 7/9.
ORCID: https//orcid.org./0000-0003-3198-8990
Пандемия новой коронавирусной инфекции (COVID-19) привела к росту потребности системы здравоохранения в определенных медицинских изделиях. Снижение административной нагрузки на производителей, ускорение процедуры регистрации, другие меры по упрощению доступа на рынок медицинских изделий, необходимых для борьбы с COVID-19, создают риски снижения их эффективности и безопасности. Авторами статьи выявлены категории медицинских изделий, необходимых для борьбы с COVID-19, получившие упрощенный доступ в гражданский оборот, оценен риск возникновения проблем с их эффективностью и безопасностью в соответствии с информацией регулятора. Представлен анализ информационных писем Росздравнадзора, который показал рост количества сообщений о новых данных по безопасности и их доли в общей структуре информационных писем о медицинских изделиях за два года (с 1 % до 4,4 %). Также в ходе анализа выявлен рост числа писем о незаконно находящихся в обращении медицинских изделиях для борьбы с COVID-19 (недоброкачественных, незарегистрированных и др.). В условиях упрощения и ускорения процедуры регистрации, направленных на бесперебойное обеспечение системы здравоохранения медицинскими изделиями для борьбы с COVID-19, особое значение приобретает усиление контроля за обращением медицинских изделий, а также усиление внутреннего контроля качества и безопасности медицинской деятельности. Автором предложены рекомендации для работников медицинских организаций в рамках мониторинга безопасности медицинских изделий. В частности, отмечена важность направления извещений в Росздравнадзор и производителю в случае наступления или угрозы наступления неблагоприятных событий, связанных с применением медицинских изделий.
Ключевые слова: медицинские изделия, медицинские изделия для борьбы с COVID-19, обращение медицинских изделий, безопасность медицинских изделий, безопасность медицинской деятельности
Введение
В 2020 году пандемия новой коронавирусной инфекции (COVID-19) поставила целый ряд серьезнейших вызовов перед системой здравоохранения, требующих немедленного решения. В том числе существенно возросла потребность в определенных медицинских изделиях (далее – МИ): аппаратах искусственной вентиляции легких, систем оксигенации, искусственного кровообращения, пульсоксиметров и других, а также в новых диагностических возможностях. Так, уже в конце 2020 года Всемирная организация здравоохранения зафиксировала появление сотен новых тестов для выявления COVID-19. При этом отмечено, что в большинстве случаев их эффективность была не подтверждена или подтверждена недостаточно [1].
Ряд оперативных мер, принятых регуляторами всех стран, в том числе России, привел к адаптации рынка МИ, наращиванию объемов производства и выходу в гражданский оборот необходимого для оказания медицинской помощи ассортимента МИ в достаточном количестве.
В то же время в этих условиях снижение административной нагрузки на производителей, упрощение процедуры регистрации, другие меры по упрощению доступа на рынок МИ, необходимых для борьбы с COVID-19, создают риски снижения их эффективности и безопасности.
Цель исследования
Цель исследования – выявить категории МИ, необходимых для борьбы с COVID-19, получивших упрощенный доступ в гражданский оборот, оценить риск возникновения проблем с их эффективностью и безопасностью в соответствии с информацией регулятора.
Материалы и методы
Проанализированы основные нормативные акты в сфере обращения МИ, упростившие процедуру регистрации МИ, необходимых для борьбы с COVID-19, выделены основные группы таких изделий. Изучены информационные письма о МИ, размещенные на официальном сайте Росздравнадзора в информационно-телекоммуникационной сети «Интернет» (https://roszdravnadzor.gov.ru) за период 2020–2021 гг. Из общего числа писем Росздравнадзора за два года (8583 ед.) выделены письма о незаконно находящихся в обороте МИ (фальсифицированных, недоброкачественных, незарегистрированных, отозванных, изъятых из обращения и др.) и о новых данных по безопасности. Изучены письма надзорного органа, содержащие информацию об аппаратах искусственной вентиляции легких, принадлежностях к ним, систем оксигенации, систем искусственного кровообращения, МИ для выявления COVID-19, средств защиты, диагностики (термометров, пульсоксиметров), облучателей бактерицидных.
Обработка данных: использовались методы анализа, синтеза, аналогии, индукции. Статистический анализ полученных данных осуществлялся с помощью классических процедур и методов: данные представлены в виде абсолютных значений и долей от целого. Сравнение долей между несвязанными выборками осуществлялось критерием хи-квадрат.
Результаты и обсуждение
В 2020 г. в условиях изменившихся потребностей системы здравоохранения с целью предотвращения дефицита для ряда МИ, необходимых для борьбы с COVID-19, Правительством РФ была введена ускоренная регистрация1.
Внесены изменения в действующие Правила государственной регистрации МИ2 в части введения особого порядка регистрации МИ с низкой степенью потенциального риска применения (костюмы изолирующие, бахилы, респираторы, перчатки смотровые/процедурные и другие средства индивидуальной защиты). Определен упрощенный порядок государственной регистрации для данных изделий, предполагающий установление одного из трех вариантов статуса для каждого МИ:
- изделие зарегистрировано в установленном порядке на основании сокращенного перечня документов, при этом его государственная регистрация не подтверждена (экспертиза качества, эффективности и безопасности не проводилась);
- изделие зарегистрировано, при этом его государственная регистрация подтверждена (экспертиза качества, эффективности и безопасности проведена);
- государственная регистрация МИ отменена (если в течение 150 рабочих дней с момента регистрации не предоставлены все необходимые документы). В этом случае реализация и применение МИ не допускается.
В течение года Росздравнадзором зарегистрировано более 1500 МИ, отменено 260 регистрационных удостоверений, подтвердили регистрацию 20 МИ [2].
Также особенности регистрации для ряда МИ (изделий для выявления и изучения COVID-19, аппаратов искусственной вентиляции легких и других) в период борьбы с COVID-19 были определены Постановлением Правительства Российской Федерации от 03.04.2020 № 430 «Об особенностях обращения медицинских изделий, в том числе, государственной регистрации серий (партий) медицинского изделия»3. Регистрационное удостоверение выдается по упрощенной и ускоренной процедуре на серию (партию) МИ, указанных в перечне к этому постановлению (в настоящее время перечень содержит 449 наименований). К обращению разрешена лишь та серия (партия), которая указана в регистрационном удостоверении. При этом срок действия таких регистрационных удостоверений ограничен (в настоящее время – до 1 января 2025 года). Кроме того, допускается реализация не зарегистрированных в Российской Федерации МИ одноразового применения по указанному перечню, если они зарегистрированы в стране-производителе.
Потребности системы здравоохранения, наряду с ускорением и упрощением процедуры регистрации, закономерно привели к существенному росту производства и, соответственно, увеличению количества и номенклатуры указанных видов МИ в гражданском обороте.
Так, по данным Росздравнадзора (Информационное письмо от 14.03.2022 № 01И-258/22) на 04.03.2022 зарегистрировано 478 различных наборов реагентов, предназначенных для этиологической лабораторной диагностики новой коронавирусной инфекции COVID-19 (выявления РНК SARS-CoV-2 с применением МАНК, антигенов SARS-CoV-2 с применением иммунохроматографических методов, иммуноглобулинов классов А, М, G (IgA, IgM и IgG) к SARS-CoV-2) [3].
Указанные обстоятельства в дополнение к другим принимаемым Правительством Российской Федерации мерам, например, ограничение осуществления государственного контроля в сфере обращения МИ [4], способствуют дополнительному повышению рисков попадания и нахождения в гражданском обороте недоброкачественных партий.
В этих условиях вопросы безопасности применения МИ становятся крайне актуальными.
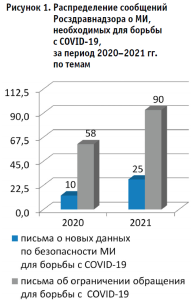
Анализ информационных писем за период 2020–2021 гг. на сайте Росздравнадзора показал, что из общего количества писем за 2020 год (995 ед.), сообщений о новых данных по безопасности МИ, включенных в перечни вышеуказанных нормативных актов, опубликовано 10 (1,0%). Доля таких сообщений в 2021 году из общего числа писем (569 ед.) существенно (р < 0,05) выросла (4,4%) (рис. 1). При этом, если в 2020 году новые данные о безопасности выявлены только для двух категорий МИ: для диагностики COVID-19 – 6 писем (8,8 % из общего числа писем о МИ для борьбы с COVID-19) и аппаратов искусственной вентиляции легких – 4 (5,9%), то в 2021 году – для большинства категорий МИ.
Например, в письме Росздравнадзора от 15.09.2020 № 01И-1786/20 содержится информация компании ООО «ДжиИ Хэлскеа», уполномоченного представителя производителя медизделия «Аппарат искусственной вентиляции легких CARESCAPE R860 с принадлежностями», производства «Дэтекс-Охмеда, Инк.», США, регистрационное удостоверение от 29.05.2020 № РЗН 2016/4722 [3]. Выявлено, что датчик кислорода в некоторых аппаратах CARESCAPE R860 потенциально может иметь неисправность, которая создает возможность неточного отображения значения доли выдыхаемого кислорода (Fi02), отличающегося от подаваемого количества, даже если пациенту подается правильное количество Fi02 (установленное медицинским работником). Принятие решения об экстубации на основании неточно измеренного значения Fi02 может повлечь за собой неоптимизированное решение об экстубации. Поставщики медицинских услуг проинформированы, что необходимо обеспечить установление предела сигнала тревоги по Fi02 в принимаемое по умолчанию заводское значение предела +/6%. Медицинский работник должен быть предупрежден, если измеренное значение будет отличаться от установленного значения. Для принятия решения об экстубации предложено использовать установленное значение Fi02 вместо значения Fi02, измеренного датчиком кислорода.
В письме Росздравнадзора от 16.12.2020 № 01И-2358/20 содержится новая информация по безопасности ООО «Орто-Клиникал Диагностике», уполномоченного представителя производителя Калибратора VITROS Коронавирус SARS-CoV-2 IgG для калибровки анализаторов серии VITROS при иммунодиагностическом определении иммуноглобулинов класса G к коронавирусу SARS-CoV-2 методом усиленной хемилюминесценции на анализаторах серии VITROS, лот 0190, регистрационное удостоверение от 07.07.2020 № РЗН 2020/11206 [3]. Компанией подтверждено повышение результатов сигнала выше уровня среза для образца во время использования калибратора из указанного лота и предложена замена (компенсация) пользователям.
Также отмечается рост (р < 0,05) числа писем о незаконно находящихся в обращении МИ для борьбы с COVID-19 (недоброкачественных, незарегистрированных и др.): из общего количества писем за 2020 год (995 ед.), сообщений о незаконно находящихся в обращении МИ опубликовано 58 (5,8%). В 2021 году опубликовано 90 писем о таких МИ (15,8%) (рис. 1). При этом, до появления (COVID-19) в 2019 году доля сообщений о МИ из перечня была еще меньше – 2,3%. В структуре указанных писем преобладают (р < 0,05) сведения о выявлении недоброкачественных МИ (в 2020 году – 15 ед., в 2021 году – 22 ед.). В 2020–2021 гг. опубликованы письма по всем группам МИ для борьбы с COVID-19. Преобладают (р < 0,05) сведения об ограничении обращения различных видов средств защиты (халаты, костюмы, бахилы, респираторы, маски, перчатки).
В частности, в письме Росздравнадзора от 28.07.2021 № 01И-977/21 субъектам обращения МИ предложено провести проверку наличия в обращении респиратора медицинского «СПИРО-213» ТУ 9398-011-08625805-2011», производства АО «Кимрская фабрика им. Горького», Россия, регистрационное удостоверение от 06.02.2017 № ФСР 2011/11948, провести мероприятия по предотвращению обращения на территории Российской Федерации недоброкачественного МИ и о результатах проинформировать соответствующий территориальный орган Росздравнадзора [3].
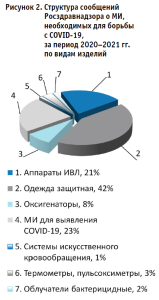
В целом, в структуре сообщений о МИ, необходимых для борьбы с COVID-19 преобладают (р < 0,05) письма о защитной одежде, МИ для выявления COVID-19, аппаратах искусственной вентиляции легких (рис. 2).
Таким образом, на фоне упрощения и ускорения процедуры регистрации, разрешения использования незарегистрированных МИ, активно применяемых для борьбы с COVID-19, отмечается рост проблем с их безопасностью, регулярно ограничивается обращение таких МИ. Полученные данные свидетельствуют о необходимости принятия дополнительных мер по безопасному применению таких изделий медицинскими организациями.
Ответственному лицу медицинской организации необходимо отслеживать все новые письма, опубликованные на сайте Росздравнадзора. При выявлении незаконно находящихся в обращении МИ на этапе приемки или после получения информации по ранее поставленным МИ необходимо переместить МИ в выделенную, обозначенную и изолированную зону «карантинного хранения» в случае приостановления – до публикации информационного письма о возобновлении применения. Особое внимание следует уделить безопасному применению аппаратов искусственной вентиляции легких, МИ для диагностики COVID-19.
Также крайне важно в рамках мониторинга безопасности направлять извещения в Росздравнадзор и производителю в случае наступления или угрозы наступления неблагоприятных событий, связанных с применением МИ.
Заключение
На фоне упрощения и ускорения процедуры регистрации, других регуляторных мер, направленных на бесперебойное обеспечение медицинских организаций МИ, необходимых для борьбы с COVID-19 в достаточных количествах, закономерно отмечается рост проблем с их эффективностью и безопасностью, регулярно ограничивается обращение таких МИ, в первую очередь, защитной одежды, аппаратов искусственной вентиляции легких, диагностических МИ. Полученные данные свидетельствуют о необходимости принятия дополнительных мер по безопасному применению таких изделий медицинскими организациями.
Ключевыми направлениями деятельности по обеспечению безопасного применения МИ для медицинской организации в условиях распространения COVID-19 должен являться контроль нахождения МИ в гражданском обороте на законных основаниях как на этапе приемки, так и, что не менее важно, на этапах хранения и использования, а также сообщение о неблагоприятных событиях при оказании медицинской помощи в рамках мониторинга безопасности. Медицинским организациям, в которых успешно функционируют системы управления качеством и безопасностью медицинской деятельности, включая безопасность применения МИ, проще справляться с нестандартными ситуациями, новыми задачами, обусловленными, в том числе появлением COVID-19.
_______________________________________________________________________
1 Постановление Правительства РФ от 18.03.2020 № 299 «О внесении изменений в Правила государственной регистрации медицинских изделий». – Собрание законодательства РФ, 23.03.2020. – № 12. – ст. 1792.
2 Постановление Правительства РФ от 27.12.2012 № 141 «Об утверждении Правил государственной регистрации медицинских изделий»: офиц. текст [Электронный ресурс]. – Режим доступа: https://base.garant.ru/70291692/ (дата обращения: 12.09.2022).
3 Постановление Правительства РФ от 03.04.2020 № 430 «Об особенностях обращения медицинских изделий, в том числе государственной регистрации серий (партий) медицинского изделия»: офиц. текст [Электронный ресурс]. – Режим доступа: https://www.garant.ru/products/ipo/prime/doc/73749698/(дата обращения: 12.09.2022).
- SARS-CoV-2 Antigen detecting rapid diagnostic test implementation projects, 27 November 2020 // – World Health Organization: [сайт]. – URL: https://www.who.int/news-room/articles-detail/sars-cov-2-antigen-detecting-rapid-diagnostictest-implementation-proposals (дата обращения: 12.09.2022).
- Слушания Росздравнадзора по правоприменительной практике за 2020 год. Росздравнадзор // Федеральная служба по надзору в сфере здравоохранения: [сайт]. – URL: https://roszdravnadzor.gov.ru/news/25148 (дата обращения: 12.09.2022).
- Информационные письма о медицинских изделиях. Электронные сервисы Росздравнадзора // Федеральная служба по надзору в сфере здравоохранения: [сайт]. – URL: https://roszdravnadzor.gov.ru/services/unreg (дата обращения: 12.09.2022).
- Итоговый доклад Росздравнадзора по результатам обобщения правоприменительной практики федерального государственного контроля (надзора) за обращением медицинских изделий (приложение 3 к приказу Росздравнадзора от 25.02.2022 № 1372) // Федеральная служба по надзору в сфере здравоохранения: [сайт]. – URL: https://roszdravnadzor.gov.ru/discussion1/control/prevention/doc21 (дата обращения: 12.09.2022).
