ФАРМАКОНАДЗОР
Безопасность ингибиторов РНК-зависимой РНК-полимеразы COVID-19 по данным спонтанных сообщений*
1 — ФГБУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, 125993, Российская Федерация, г. Москва, Баррикадная улица, д. 2/1.
2 — ФГБУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, 125993, Российская Федерация, г. Москва, Баррикадная улица, д. 2/1.
3 — ФГБУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, 125993, Российская Федерация, г. Москва, Баррикадная улица, д. 2/1.
4 — ФГБУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, 125993, Российская Федерация, г. Москва, Баррикадная улица, д. 2/1.; ГБУЗ «Городская клиническая больница № 15 им. О.М. Филатова Департамента здравоохранения г. Москвы», 111539, Российская Федерация, г. Москва, ул. Вешняковская, д. 23.
5 — ФГБУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, 125993, Российская Федерация, г. Москва, Баррикадная улица, д. 2/1.
6 — ФГБУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, 125993, Российская Федерация, г. Москва, Баррикадная улица, д. 2/1.
В статье проанализированы случаи развития нежелательных реакций при использовании трех противовирусных препаратов для этиотропной терапии COVID-19: фавипиравира, ремдесивира, молнупиравира. Анализ проведен с учетом двух характеристик нежелательных реакций: серьезность и предвиденность. Авторы анализировали данные, внесенные в государственную автоматизированную информационную систему «Фармаконадзор 2.0» Росздравнадзора. Изучены клинические данные и определены специфические паттерны нежелательных явлений (НЯ). Определены основные клинические проявления нежелательных явлений молнупиравира (два сообщения), ремдесивира (24 сообщения) и фавипиравира (453 записи). При анализе динамики репортирования для фавипиравира обнаружен эффект Вебера. Авторами не было обнаружено статистически значимых отличий между группами пациентов с НЯ, стратифицированных по полу и возрасту. Автоматизированная система «Фармаконадзор» Росздравнадзора – ценный информационный ресурс, обеспечивающий выявление серьезных НЯ и, соответственно, разработку и реализацию мер по дальнейшей минимизации рисков.
Ключевые слова: коронавирусная инфекция, COVID-19, фармакотерапия, нежелательные реакции, фавипиравир, ремдесивир, молнупиравир
* Данная работа выполнена при финансовой поддержке Министерства здравоохранения Российской Федерации. Тематика государственного задания – «Факторы, влияющие на развитие неблагоприятных реакций при применении лекарственных препаратов для этиотропной и патогенетической терапии пациентов с COVID-19» (ЕГИСУ НИОКТР № 122021800155-3).
Введение
В соответствии с актуальными временными методическими рекомендациями для врачей по профилактике, диагностике и лечению COVID-19, выделены несколько этиотропных препаратов, которые могут быть использованы при лечении COVID-19: фавипиравир, молнупиравир, ремдесивир, нирматрелвир/риторавир, синтетическая малая интерферирующая двуцепочечная рибонуклеиновая кислота (миРНК), умифеновир и интерферон-альфа1. Особый интерес представляют синтетические соединения, взаимодействующие с РНК-зависимой РНК полимеразой вируса-возбудителя COVID-19 – SARS-nCoV-2, а именно фавипиравир, ремдесивир и молнупиравир (представлены в порядке государственной регистрации в Российской Федерации). Эти соединения объединяет схожий механизм действия, заключающийся в встраивании своих активных метаболитов в РНК, способствующий нарушению функций полимеразы, накоплению мутаций и обрыву цепи, т.е. к прекращению репликации вирусов [8, 12, 14].
В настоящий момент накоплены противоречивые данные об эффективности препаратов этой группы, в т.ч. отличаются друг от друга и результаты клинических исследований и систематических обзоров [4, 6, 7, 9, 10]. Следует отметить, что накопление доказательной базы эффективности применения является прежде всего вопросом времени. При этом проблема безопас ного применения фавипиравира, ремдесивира и молнупиравира в условиях ограниченных клинических данных и высокой потребности населения и систем здравоохранения в противовирусных средствах становится еще более актуальной. Все три указанных препарата в настоящий момент зарегистрированы на территории Российской Федерации2 и используются в медицинских организациях страны, а фавипиравир с 17 сентября 2020 г. назначается и амбулаторным пациентам. Следует добавить, что все указанные противовирусные средства являются препаратами рецептурного отпуска.
Одним из наиболее информативных и доступных методов сбора информации по безопасности лекарственных средств является метод спонтанных сообщений. В Российской Федерации организована и функционирует государственная система фармаконадзора, в которой все субъекты обращения лекарственных препаратов могут, а некоторые (медицинские работники, держатели регистрационных удостоверений, например) должны, сообщать о развившихся осложнениях фармакотерапии в соответствующий уполномоченный орган исполнительной власти, которым является Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор). С 2008 года в стране функционирует государственная база данных спонтанных сообщений «Фармаконадзор», поддержка которой осуществляется Росздравнадзором3,4 [15].
Цель работы
Целью нашей работы явилось изучение безопасности фавипиравира, ремдесивира и молнупиравира по данным спонтанных сообщений, поступивших в Автоматизированную информационную систему «Фармаконадзор 2.0» Росздравнадзора.
Материалы и методы
В качестве объекта исследования нами были выбраны спонтанные сообщения, присланные субъектами обращения лекарственных средств согласно требованиям законодательства, и внесенные в Автоматизированную информационную систему «Фармаконадзор 2.0» Росздравнадзора. Выбор лекарственных препаратов (ЛП) в системе осуществлялся по международному непатентованному названию (МНН): «ремдесивир», «молнупиравир», «фавипиравир»), а также по коду анатомо-химическотерапевтической классификации ВОЗ (АТХ): J05AX27 – для фавипиравира, J05AB16 – для ремдесивира, а для молнупиравира поиск осуществляли по коду четвертого уровня J05A, т.к. на момент проведения исследования полный семизначный код для этого лекарственного средства официально не присвоен. Сообщения импортировались из АИС Росздравнадзора в виде электронных таблиц MS Excel, после чего анализировались их основные характеристики. Кодирование проявлений нежелательных явлений (НЯ) / нежелательных реакций (НР), отмеченных в извещениях, осуществлялось в MedDRA 25.0, дополнительно определялись системно-органные классы (SOC). При анализе распределений ориентировались на первичный системно-органный класс (Primary SOC). Период поиска – с 1 января 2020 года по 31 мая 2022 года. Оценка проводилась независимо тремя экспертами, спорные случаи обсуждались совместно с другими участниками исследования. Исследователями принималось во внимание, что одно извещение могло содержать несколько критериев серьезности и указание на несколько наблюдаемых источником исходов неблагоприятного события. Для статистической обработки данных использовали программное обеспечение PaST 4.11 (г. Осло, Норвегия) и R 4.2.0.
Результаты и их обсуждение
Всего за период 01.01.2020 – 31.05.2022 гг. в АИС «Фармаконадзор 2.0» Росздравнадзора поступило 479 спонтанных сообщений, из которых в двух сообщалось о развитии НР при применении молнупиравира (торговое название представлено одним лекарственным препаратом (ЛП)), в 24 – ремдесивира (три ЛП разных держателей регистрационных удостоверений (ДРУ)) и в 453 – фавипиравира (пять ЛП разных ДРУ). Такое малое количество сообщений о НЯ/НР молнупиравира мы объясняем недавним сроком регистрации этого препарата на территории РФ. Принимая во внимание, что в одном извещении может содержаться информация о нескольких НР, общее количество зарегистрированных НР составило 747 (молнупиравир – 2, ремдесивир – 31 и фавипиравир – 714). Среднее количество репортируемых явлений в одном сообщении, соответственно, составляет 1 для молнупиравира, 1,29 – для ремдесивира и 1,58 – для фавипиравира (рис. 1).
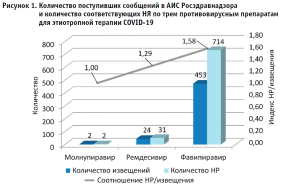
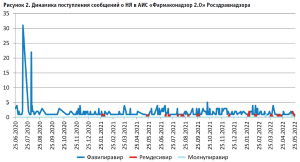
Примечательна динамика поступлений сообщений (рис. 2). В то время как для ремдесивира и молнупиравира она не имеет выраженных особенностей и примерно монотонна с момента регистрации, для фавипиравира наблюдается рост количества поступивших извещений в июне и июле 2020 года. Это совпадает с датами государственной регистрации первых ЛП фавипиравира на российском рынке. Таким образом, можно констатировать, что для фавипиравира в Российской Федерации наблюдался известный специалистам по фармаконадзору «эффект Вебера» – увеличение количества сообщений в первые месяцы после регистрации. Отличием наблюдаемого нами эффекта от «классического» является его непродолжительность (1–2 месяца вместо периода от 6-9 месяцев до двух лет) [2, 5].
При анализе распределения отобранных случаев по полу и возрасту было обнаружено, что большинство реакций развивалось у пациентов женского пола. Так, в группе фавипиравира о случаях НЯ, развившихся у женщин, было получено 267 сообщений (58,94%; 95% ДИ 54,25: 63,51), в группе ремдесивира таких было 14 (58,33%; 95% ДИ 36,64: 77,89), а в группе молнупиравира оба случая были зарегистрированы у пациентов мужского пола. Статистически значимых отличий между группами в распределении изученных случаев по полу не обнаружено (χ^2 = 2,85; P = 0,24; Pточного теста Фишера-Фримена-Гальтона = 0,335).
На следующем этапе мы проанализировали распределение известных случаев по возрасту пациентов, у которых регистрировались НЯ. Средний возраст пациентов, у которых были зафиксированы НЯ при применении молнупиравира, составил 42 года (95% ДИ 0-92,82), ремдесивира – 53 года (95% ДИ 44,58-60,0), а фавипиравира – 50 лет (95% ДИ 49,58-52,65).
Для 14 пациентов в последней группе возраст был не указан. Распределение по возрастным периодам риска для всех изученных групп и в целом по препаратам этиотропной терапии приведено на рисунке 3 (представлены средняя арифметическая, границы 1-го и 3-го квартилей, диапазон данных и особенности распределения по возрастным группам – чем толще диаметр фигуры по горизонтальной оси, тем больше количество пациентов в данной возрастной подгруппе).

Следует отметить, что статистически значимых отличий между группами при этом выявлено не было (TКраскела-Уоллиса = 0,705; P = 0,703). Наши данные подтверждают наблюдения арабских и китайских исследователей, не нашедших подтверждения взаимосвязи пола и возраста и риска развития НР у пациентов с COVID-19 [1, 11]. Источники сообщений о НЯ/НР изучаемых ЛП представлены на рисунке 4.
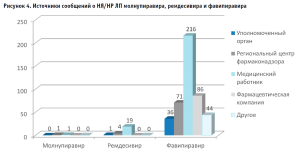
Анализ различий с использованием точного теста Фишера-Фримана-Гальтона обнаружил отличие на уровне статистической значимости P = 0,021. Отличие между группой ремдесивира и фавипиравира (P = 0,009) можно объяснить большим сроком регистрации фавипиравира на российском рынке и его использованием в амбулаторной практике.
Клинические проявления НР/НЯ молнупиравира проявлялись брадикардией (SOC: нарушения со стороны сердца) и ангионевротическим отеком (SOC: нарушения со стороны кожи и подкожной клетчатки). Оба случая были расценены источником как клинически значимое событие, т.е. отвечали принятым в ЕАЭС критериям серьезности, и завершились с улучшением состояния пациентов.
Наиболее частыми проявлениями НЯ/ НР ремдесивира являются симптомы поражения печени (12 проявлений) и реакции гиперчувствительности (7 терминов). Все проявления гиперчувствительности и поражения печени, равно как и инфузионные осложнения (гипотензия) были расценены нами как предвиденные. Обращает на себя внимание случай зарегистрированного острого панкреатита, сопровождавшийся увеличением уровня амилазы и болями в верхних отделах живота. Оценить степень достоверности причинно-следственной связи с применением ремдесивира в данном случае оказалось невозможно, т.к. имела место значительная полипрагмазия и тяжелое течение основного заболевания.
Ретроспективно оценить значение информации о двух случаях повышения уровня креатинина в крови у пациентов, принимавших ремдесивир, достаточно сложно, т.к. данный симптом мог быть как проявлением основного заболевания, так и симптомом лекарственного поражения почек. Два недавних масштабных исследования безопасности ремдесивира с использованием баз данных ВОЗ и FAERS выявили ассоциацию между острой почечной недостаточностью и применением ремдесивира [3, 13]. Поражение почек в момент проведения нашего исследования не включено в инструкции по медицинскому применению ремдесивира ни в одной из стран обращения этого средства.
На основании опубликованных анализов баз данных Росздравнадзором был сформирован новый сигнал по безопасности, окончательное решение по которому будет принято после завершения дополнительных клинических исследований и анализа новых данных о пострегистрационном использовании ремдесивира. Также к заслуживающим дополнительного внимания событиям мы отнесли гипертензию, петехии и гипестезию в месте инфузии.
На следующем этапе мы проанализировали распределение сообщений с подозреваемым препаратом “Ремдесивир” по критериям серьезности. Преобладали сообщения о серьезных НЯ/НР (89%). Жизнеугрожающая ситуация была ассоциирована с гипотензией, обусловленной инфузией ремдесивира. Дополнительной информации по случаю источником представлено не было.
Исходы случаев были в большей части благоприятными. Улучшение состояния пациентов наблюдалось в 12 случаях, выздоровление без последствий – в четырех, состояние без изменений отмечено в двух случаях и в шести извещениях исход неблагоприятного события был определен как «неизвестно».
Клинические проявления НЯ/НР ЛП, содержащих фавипиравир намного разнообразнее, что можно объяснить значительно большим количеством сообщений в АИС «Фармаконадзор». Как и в случае с ремдесивиром, на первое место среди проявлений вышли признаки лекарственного поражения печени (253 проявления; 35,43%), из которых абсолютное большинство было представлено случаями развития гипертрансаминаземий. Проявления реакций гиперчувствительности разного типа, в т.ч. тяжелые и жизнеугрожающие (ангионевротический отек с отеком гортани, анафилактический шок, токсический эпидермальный некролиз) отмечались в 102 (14,29%) случаях проанализированных НЯ/НР. Гиперурикемия, которая считается некоторыми авторами ведущим по частоте осложнением терапии фавипиравиром, встречалась только в 3,64% (26 НР) случаев, однако в одном извещении сообщалось о развитии подагры.
Особое внимание обращает на себя группа сообщений о НЯ со стороны сердечно-сосудистой системы, а именно о нарушении ритма (22). Со стороны крови НЯ (18 проявлений) развивались в виде цитопении, лейкопении, нейтропении, тромбоцитопении, лейкоцитоза, моноцитоза, тромбоцитоза. Наблюдались и извещения о проявлениях расстройств коагуляции (10):
- гематохезия;
- снижение уровня фибриногена в крови;
- увеличение времени кровотечения;
- гематемезис;
- повышение международного нормализованного отношения (МНО);
- кровоизлияние в глаз.
Как и в случае применения ремдесивира, в группе НЯ/НР, ассоциированных с приемом фавипиравира, нами были зарегистрированы проявления, не указанные в ИМП ЛП фавипиравира на момент его регистрации в РФ, в т.ч. психической сферы – сомнолентность, спутанность сознания, тревожность (по два случая), тремор (два случая), алопеция (два случая), а также со стороны других органов и систем – панкреатит (один случай), неуточненное повреждение почек (один случай), неуточненное расстройство зрения и уменьшение остроты зрения (по одному случаю), икота (один случай), галлюцинации, нервозность, и дезориентация (по одному случаю).
Особое внимание было уделено случаям применения фавипиравира у беременных женщин и соблюдению мер минимизации риска наступления беременности, которые были введены в отношении данного ЛП и которые предполагают проведение теста на беременность до и после курса терапии фавипиравиром и соблюдение метода двойной контрацепции. В анализируемой нами выборке обнаружено восемь сообщений о наступлении беременности, исход которой источником не сообщался, а также один случай самопроизвольного аборта. Примечательно, что о всех случаях информация в Росздравнадзор поступила от представителей фармацевтических компаний. На наш взгляд, это может свидетельствовать о зрелости систем фармаконадзора ДРУ на ЛП фавипиравир.
На этапе анализа извещений о НЯ/ НР по критериям серьезности было выявлено, что более половины всех внесенных в АИС случаев были расценены первоисточником как серьезные (55%). Таким образом, в группе фавипиравира по сравнению с ремдесивиром статистически значимо более часто репортировались несерьезные явления (χ^2 = 9,769; P = 0,002; Pточного теста Фишера = 0,0008). Улучшение состояния пациентов после НЯ/НР наблюдалось в 205 случаях, выздоровление без последствий – в 108, состояние без изменений отмечено в 58 случаях и в 76 извещениях исход события был определен как «неизвестно».
Выводы
Результаты нашей работы свидетельствуют, что изучение безопасности противовирусных препаратов, используемых для этиотропной терапии COVID-19, а именно ингибиторов РНК-зависимой РНК-полимеразы, посредством анализа базы данных спонтанных сообщений является доступным и информативным методом. АИС «Фармаконадзор 2.0» Росздравнадзора содержит необходимые данные для выявления основных характеристик и закономерностей развития НЯ/НР препаратов этой группы, а также позволяет определить основные направления дальнейшей активности в направлении минимизации рисков.
Авторам представляется целесообразным постоянный мониторинг и углубленный анализ поступающих в государственную базу данных по безопасности сообщений, а в отношении новых данных по безопасности – проведение дополнительных пострегистрационных исследований безопасности, которые должны быть в том числе посвящены вопросам взаимодействия этиотропных средств с препаратами других групп.
______________________________________________________________________
1 Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) 16-е изд., Москва: Министерство здравоохранения Российской Федерации, 2022. 249 c.
2 Государственный реестр лекарственных средств [Электронный ресурс]. URL: https://grls.rosminzdrav.ru/ (дата обращения: 24.09.2020).
3 Приказ Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
4 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» (последняя редакция) / КонсультантПлюс [Электронный ресурс]. URL: http://www.consultant.ru/document/cons_doc_LAW_99350/ (дата обращения: 29.02.2020).
- Alshehail B. [et al.] Incidence and risk factors of adverse drug reactions in patients with coronavirus disease 2019: A pharmacovigilance experience utilizing an ADR trigger tool // Saudi Pharmaceutical Journal. – 2022. – № 4 (30). – P. 407–413.
- Arora A., Jalali R., Vohora D. Relevance of the Weber effect in contemporary pharmacovigilance of oncology drugs // Therapeutics and Clinical Risk Management. – 2017. – Vol.13. – P. 1195–1203.
- Ge’rard A.O. [et al.] Remdesivir and Acute Renal Failure: A Potential Safety Signal from Disproportionality Analysis of the WHO Safety Database // Clinical Pharmacology & Therapeutics. – 2021. – № 4 (109). – P. 1021–1024.
- Hassanipour S. [et al.] The efficacy and safety of Favipiravir in treatment of COVID-19: a systematic review and meta-analysis of clinical trials // Scientific reports. – 2021. – № 1 (11). – P. 11022.
- Hoffman K.B. [et al.] The Weber effect and the United States Food and Drug Administration’s Adverse Event Reporting System (FAERS): analysis of sixty-two drugs approved from 2006 to 2010 // Drug safety. – 2014. – № 4 (37). – P. 283–94.
- Manabe T. [et al.] Favipiravir for the treatment of patients with COVID-19: a systematic review and meta-analysis // BMC infectious diseases. – 2021. – № 1 (21). – P. 489.
- Mart nez V.G., Salas A.A., Ballest n S.S. Antiviral Therapeutic Approaches for SARS-CoV-2 Infection: A Systematic Review // Pharmaceuticals (Basel, Switzerland). – 2021. – № 8 (14). – P. 736.
- Матвеев А.В., Киселёв Ю.Ю., Сычёв Д.А. Возможность и перспективы применения препарата фавипиравир у пациентов с COVID-19 // Качественная клиническая практика. – 2020. – № 4S. – C. 106–114.
- Qomara W.F. [et al.] Effectiveness of Remdesivir, Lopinavir/ Ritonavir, and Favipiravir for COVID-19 Treatment: A Systematic Review // International journal of general medicine. – 2021. № 14. – P. 8557–8571.
- Shrestha D.B. [et al.] Favipiravir versus other antiviral or standard of care for COVID-19 treatment: a rapid systematic review and meta-analysis // Virology journal. – 2020. – № 1 (17). – P. 141.
- Sun J. [et al.] Incidence of Adverse Drug Reactions in COVID-19 Patients in China: An Active Monitoring Study by Hospital Pharmacovigilance System // Clinical Pharmacology & Therapeutics. – 2020. – № 4 (108). – P. 791–797.
- Цветов В.М., Мирзаев К.Б., Сычёв Д.А. Возможность и перспективы применения препарата ремдесивир у пациентов с COVID-19 // Качественная клиническая практика. – 2020. – № 4S. – C. 99–102.
- Wu B. [et al.] Acute Kidney Injury Associated with Remdesivir: A Comprehensive Pharmacovigilance Analysis of COVID-19 Reports in FAERS // Frontiers in Pharmacology. – 2022. – № 13. – P. 692828
- Жирнов О.П., Чернышова А.И. Фавипиравир: скрытая опасность мутагенного действия // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2021. – № 2 (98). – C. 213–220.
- Колбин А.С. Фармаконадзор / А.С. Колбин, С.К. Зырянов, Д.Ю. Белоусов, Л.И. Логиновская, О.А. Карпенко, А.В. Матвеев [и др.]. – Москва: ОКИ: Буки-Веди, 2019. – 248 c.
