РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Анализ запросов уполномоченных органов при регистрации воспроизведенных лекарственных препаратов
1 — ООО «Парма Клиникал», 614101, Российская Федерация, г. Пермь, ул. Причальная, 1б, корп. 3.
ORCID: https://orcid.org/0000-0001-8164-6521
2 — ООО «Парма Клиникал», 614101, Российская Федерация, г. Пермь, ул. Причальная, 1б, корп. 3.; Федеральное государственное образовательное учреждение высшего образования «Пермская государственная фармацевтическая академия» Минздрава России, 614990, Российская Федерация, г. Пермь, ул. Полевая, д. 2.
ORCID: https://orcid.org/0000-0002-3752-7848
3 — Федеральное государственное образовательное учреждение высшего образования «Пермская государственная фармацевтическая академия» Минздрава России, 614990, Российская Федерация, г. Пермь, ул. Полевая, д. 2.; Федеральное государственное автономное образовательное учреждение высшего образования «Пермский государственный национальный исследовательский университет», 614990, Российская Федерация, г. Пермь, ул. Букирева, 15.
ORCID: http://orсid.org/0000-0001-5579-394X
4 — ООО «Парма Клиникал», 614101, Российская Федерация, г. Пермь, ул. Причальная, 1б, корп. 3.
ORCID: http://orcid.org/0000-0001-5755-4184
Нормативно-правовое регулирование обращения лекарственных средств на территории Евразийского экономического союза устанавливает направление запросов со стороны уполномоченных органов в рамках экспертизы лекарственных препаратов при осуществлении процедуры регистрации.
Качественные характеристики таких запросов, а именно количество пунктов и значимость требуемой информации регистрационного досье влияет на эффективность и результативность процессов его подготовки на уровне организации-разработчика воспроизведенных лекарственных препаратов, а также на возможность своевременного вывода препаратов на рынок.
В целях управления процессами регистрации и подготовки регистрационного досье авторами статьи был подготовлен анализ запросов уполномоченных органов при регистрации воспроизведенных лекарственных препаратов, который позволил установить значимые причины несоответствий и отрицательных экспертных заключений.
Полученные результаты позволили обосновать подходы к оптимизации регистрационных процедур на уровне организации-разработчика воспроизведенных лекарственных препаратов.
Ключевые слова: регистрация лекарственных препаратов, подготовка регистрационного досье на лекарственные препараты, эффективность организации регистрации и подготовки регистрационного досье, запросы уполномоченных органов
Введение
Нормативно-правовое регулирование обращения лекарственных средств Евразийского экономического союза (ЕАЭС) предопределяет новый формат регистрации лекарственных препаратов (ЛП), включающий новые требования к составу и содержанию документов регистрационного досье (РД), новые регистрационные процедуры [1, 2].
Одобрение и утверждение РД со стороны уполномоченных органов и регистрация ЛП является одним из важных этапов, обеспечивающим возможность ввода ЛП в обращение [3]. Принятая модель экспертизы уполномоченных органов предусматривает направление запросов в ходе экспертизы с целью дополнения или прояснения представленных сведений для вынесения заключения. Заявителю направляется перечень вопросов с установлением оговоренного срока на получение ответа, затем проводится дополнительная экспертиза представленных ответов перед вынесением решения [4, 5].
В рамках проводимого исследования на базе контрактно-исследовательской организации была выявлена отрицательная динамика роста среднего количества запросов уполномоченных органов [6].
Качественный анализ запросов от уполномоченных органов (экспертной организации) Российской Федерации (Министерство здравоохранения Российской Федерации (МЗ РФ)) за период с 2018 года по первое полугодие 2022 года был проведен по процедурам: государственная регистрация ЛП, регистрация ЛП по требованиям ЕАЭС, внесение изменений по национальной процедуре, подтверждение государственной регистрации ЛП, приведение в соответствие РД ЛП согласно требованиям ЕАЭС, получение разрешения на клиническое исследование.
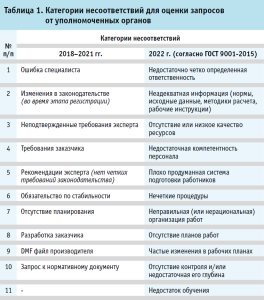
Для качественной оценки запросов от уполномоченных органов в контрактно-исследовательской организации на базе Системы обеспечения качества были разработаны категории несоответствий. В период с 2018 года по 2021 год категории сформулированы самостоятельно экспертами компании на основании анализа установленных несоответствий. В 2022 году по распоряжению генерального директора контрактно-исследовательской организации были изменены категории несоответствия согласно «ГОСТ Р ИСО 9001-2015. Национальный стандарт РФ1. Системы менеджмента качества. Требования».
В процессе анализа каждый запрос был отнесен к определенной категории, разработанной на базе контрактно-исследовательской организации (таблица 1).
Таким образом, можно распределить все пункты запроса, касающиеся отдела работы с регуляторными требованиями, по критериям несоответствия по годам (табл. 2).
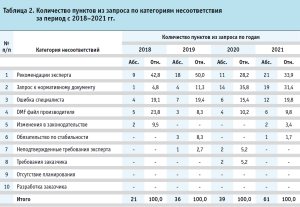
Как видно из таблицы 2, в целом отмечается рост запросов уполномоченных органов. Наиболее многочисленными группами несоответствий являются «Рекомендации эксперта» (от 28,2 до 50% от всего числа пунктов запросов МЗ РФ), «Запрос к нормативному документу» (до 35,8 % в 2020 г.) и «Ошибка специалиста» (уровень 15,4 до 19,8%). Приемлемым уровнем отклонений относительных значений по количеству пунктов из запросов по годам был принят показатель на уровне 10% включительно. Для категорий несоответствий «Рекомендации эксперта» и «Запрос к нормативному документу» выявлены наибольшие показатели отклонения (12% и 18%, соответственно).
Рекомендации эксперта формируются (как правило) в случаях, когда в регуляторных требованиях не определен четкий принцип действий или предполагается альтернативный способ оформления (наполнения) документации (например, представление ссылки на действующую спецификацию или фармакопейную). Такие пункты запросов носят рекомендательный характер, при несогласии исполнять рекомендации эксперта уполномоченных органов предполагается предоставление пояснений по пункту запроса со ссылками на достоверные литературные источники, регуляторные требования, действующие нормативно-правовые акты. Ответственность и выбор в данном случае лежит на заявителе.
Категория «Запрос к нормативному документу» был охарактеризован как несоответствие к оформлению и наполнению нормативного документа по качеству на ЛП. С 2022 года данная категория не используется по причине неприменимости к персоналу и отсутствия в ГОСТ Р ИСО 9001-2015.
За 2022 год было получено 39 запросов уполномоченных органов по различным регистрационным процедурам. Наибольшее количество несоответствий было отнесено к следующим критериям: неадекватная информация, недостаточная компетентность персонала, нечеткие процедуры.
В целом за анализируемый период 2018–2022 гг. наиболее значимыми причинами запросов можно считать ошибки персонала (недостаточная компетентность персонала) и рекомендации эксперта (нечеткие процедуры), что определяет направление оптимизации деятельности организации. Для изучения причинно-следственных связей по выявленным несоответствиям использовался метод «Пять Почему». Основной задачей метода является поиск первопричины возникновения несоответствия с помощью пятикратного повторения одного вопроса «почему?». Для проведения анализа были привлечены эксперты на уровне организации-разработчика, обладающие знаниями и опытом в областях по выявленным несоответствиям.
При анализе возникновения вероятности принятия ошибочного заключения по присвоению категории несоответствия и при отсутствии статистически значимой информации вероятность правильного вывода определяли с помощью экспертного метода «дерево отказов». В практическом аспекте описанные выше методы могут быть использованы как для оценивания общих и частных рисков при подготовке РД с целью регистрации ЛП, так и для разрабатывающихся планов мониторинга эффективности и результативности системы процессов подготовки РД и регистрации ЛП.
Алгоритм обоснования категории несоответствия на примере запроса уполномоченных органов представлен на рисунке. Представленному запросу уполномоченных органов была присвоена категория «Ошибка специалиста».
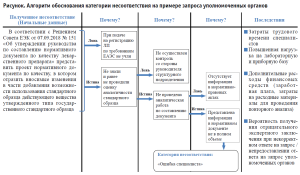
В анализе данного несоответствия определены возможные последствия (общие и частные риски):
- Затраты трудового времени: необходимость срочного результата перераспределения текущих ресурсов и корректировки планов работ, отвлечение персонала от запланированных задач для подготовки ответа на запрос, проведение повторных аналитических процедур.
- Повышенная нагрузка на лабораторную и приборную базу: использование оборудования вне установленного графика, что может привести к ускоренному износу и необходимости дополнительного обслуживания; ограничение доступа к приборам для других запланированных проектов.
- Дополнительные финансовые затраты: оплата труда сотрудников за внеплановую работу, расходование дополнительных материалов и реагентов для проведения повторных анализов.
- Вероятность получения отрицательного экспертного заключения при некорректном ответе на запрос / непредоставлении ответа на запрос уполномоченных органов, что влияет на своевременность вывода качественных, эффективных и безопасных ЛП как на рынок ЕАЭС, так и за его пределы.
В условиях применения обновленных регуляторных требований к РД и процедурам регистрации ЛП в рамках ЕАЭС наблюдается увеличение количества запросов от уполномоченных органов, анализ которых позволил установить значимые причины полученных несоответствий и отрицательных экспертных заключений, а именно: ошибки персонала (недостаточная компетентность персонала) и рекомендации эксперта (нечеткие процедуры).
Установленные первопричины несоответствий методами «Пять Почему» и «Дерево отказов» определяют необходимость повышения качества подготовки РД на основе совершенствования системы менеджмента качества и развития компетентности персонала, используя актуальные рекомендации и подходы.
Полученные результаты легли в основу обоснования подходов по оптимизации организации процессов регистрации (регистрационных процедур) и подготовки РД на уровне организации-разработчика воспроизведенных ЛП.
__________________________________________________________
1 ГОСТ Р ИСО 9001-2015 Системы менеджмента качества. Требования, 2015. Доступно по: https://www.consultant.ru/document/cons_doc_LAW_194941/ . Ссылка активна на 05.06.2024 г.
- Халимова А.А. Государственная поддержка устойчивого развития фармацевтической отрасли Санкт-Петербурга // Устойчивое развитие (ESG): финансы, экономика, промышленность. – 2022. – С. 572–576.
- Аладышева Ж.И., Береговых В.В., Мешковский А.П., Пятигорская Н.В. Фармацевтическое государственное регулирование и экспорт лекарственных средств: зарубежный опыт // Федерализм. – 2023. – № 28(3). С. 108–136. – URL: https://doi.org/10.21686/2073-1051-2023-3-108-136 /
- Зайцева Н.Ю. Современные направления обеспечения безопасности лекарственных средств // Актуальные проблемы естественных наук. – 2015. – С. 93–98.
- Ниязов Р.Р., Васильев А.Н., Гавришина Е.В., Драницына М.А. Надлежащая практика экспертизы: руководство для национальных и региональных уполномоченных органов // Ремедиум. – 2017. – №1-2. – URL: https://cyberleninka.ru/article/n/nadlezhaschaya-praktika-ekspertizy-rukovodstvo-dlyanatsionalnyh-i-regionalnyh-upolnomochennyh-organov.
- Рычихина Е.М., Ткаченко О.Г., Косенко В.В. Рекомендации для специалистов по регистрации лекарственных препаратов в целях оптимизации работ по процедурам ЕАЭС // Регуляторные исследования и экспертиза лекарственных средств. – 2023. – Т. 13. – №. 2-1. – С. 345–360.
- Конева Н.А., Фотеева А.В., Ростова Н.Б., Прозорова Н.А. Оценка эффективности и результативности процессов подготовки регистрационного досье на основе учета запросов уполномоченных органов // Вестник Росздравнадзора. – 2025. – № 4. – С. 60–66.
