НОРМАТИВНОЕ ПРАВОВОЕ РЕГУЛИРОВАНИЕ ОБРАЩЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Анализ рисков в сфере обращения лекарственных средств для детей в рамках национальной системы здравоохранения
1 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Министерства здравоохранения Российской Федерации, 197022, Российская Федерация, г. Санкт-Петербург, ул. Профессора Попова, д. 14 лит. А.
2 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Министерства здравоохранения Российской Федерации, 197022, Российская Федерация, г. Санкт-Петербург, ул. Профессора Попова, д. 14 лит. А.
3 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Министерства здравоохранения Российской Федерации, 197022, Российская Федерация, г. Санкт-Петербург, ул. Профессора Попова, д. 14 лит. А.
4 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Министерства здравоохранения Российской Федерации, 197022, Российская Федерация, г. Санкт-Петербург, ул. Профессора Попова, д. 14 лит. А.
5 — Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный химико-фармацевтический университет» Министерства здравоохранения Российской Федерации, 197022, Российская Федерация, г. Санкт-Петербург, ул. Профессора Попова, д. 14 лит. А.
В работе представлены результаты многокритериального анализа государственных закупок медицинских стационаров педиатрического профиля, клинических исследований в рамках области применения «педиатрия», а также мониторинг судебной практики в части лекарственного обеспечения детей. Авторами установлено, что в рамках рутинной клинической практики, оцениваемой по результатам закупок лекарственных препаратов медицинскими стационарами педиатрического профиля, регистрируется потребление препаратов off-label на уровне, превышающем 52%, что продиктовано как отсутствием сбалансированности национального ассортиментного портфеля препаратов для педиатрии в части специфичных лекарственных форм и дозировок, так и недостаточным уровнем клинических исследований препаратов в данной возрастной группе. Доля исследований в отношении препаратов, разработанных на территории Российской Федерации, составляет лишь 21%, что демонстрирует приоритетную ориентацию российской фарминдустрии на пациентов старше 18 лет, обусловленную сложностью и длительностью фармразработки в области педиатрии и подчеркивает потенциальные риски импортозависимости в ближайшей и среднесрочной перспективах. При этом отсутствует корреляция между динамикой заболеваемости, структурой off-label-потребления и областью применения потенциальных препаратов, что, в свою очередь, нивелирует вероятность решения вопросов применения препаратов «вне инструкции» в педиатрии в условиях современного состояния фармацевтического рынка.
Полученные результаты подчеркивают важность разработки регуляторных инициатив, направленных на совершенствование вопросов лекарственного обеспечения в педиатрии.
Ключевые слова: обращение лекарственных средств, лекарственное обеспечение в педиатрии, государственные закупки медицинских стационаров педиатрического профиля, лекарственное обеспечение несовершеннолетних, применение незарегистрированных на территории Российской Федерации лекарственных средств, off-label, применение лекарственных препаратов off-label, терапия «вне инструкции», назначение и применение лекарственных препаратов по жизненным показаниям
Введение
Эффективная система лекарственного обеспечения педиатрических пациентов является основой оказания качественной медицинской помощи детям, позволяющей рационально использовать финансовые ресурсы системы российского здравоохранения.
Однако, несмотря на ввод в гражданский оборот новых лекарственных средств для медицинского применения у детей, постепенное накопление данных о безопасности, клинической и клинико-экономической эффективности препаратов в детской популяции, расширение панели возможностей производственных аптек, изменение правового статуса зарегистрированных препаратов, назначаемых off-label на основании доказательного опыта применения по новому назначению, вопросы обоснованности врачебных назначений с приемлемым профилем убедительности доказательств в отношении педиатрических пациентов в условиях возникновения и развития ряда патологий остаются открытыми. Важно подчеркнуть, что проблема применения лекарственных препаратов в педиатрии в рамках терапии «вне инструкции» усугубляется отсутствием детских лекарственных форм.
Проведенными ранее исследованиями была определена структура российского национального фармацевтического рынка в рамках сегмента для педиатрии и обозначены перспективы оптимизации лекарственного обеспечения педиатрических пациентов в целом [1, 2].
Цель работы
Проанализировать риски обращения лекарственных средств для детей в рамках национальной системы здравоохранения.
Материалы и методы
Анализ потребления лекарственных препаратов для детей медицинскими организациями проводился на примере г. Санкт-Петербург с использованием единой информационной системы в сфере закупок (ЕИСЗ) Российской Федерации за период 2016–2023 гг. на основании выставленных электронных заявок на проведение аукциона и заключенных контрактов [3]. Для проектирования максимально корректного дизайна исследования был сформирован информационный массив, характеризующий ассортиментную матрицу лекарственных препаратов в рамках субъекта Российской Федерации.
Оценка базы данных, включающей 6159 позиций, в разрезе АТХ-классификации, а также инструкций по медицинскому применению лекарственных препаратов (ЛП), клинических рекомендаций, ориентированных на педиатрическую практику, проводилась методом контент-анализа.
Перспективы развития фармацевтического рынка в анализируемом сегменте оценивали с точки зрения текущих, приостановленных, прекращенных и завершенных клинических исследований в детской популяции в рамках области применения «Педиатрия» на основе контент-анализа реестра разрешений на проведение клинических исследований за период с 01.01.2016 г. по 31.12.2023 г. [4].
Мониторинг судебной практики проводили методом контент-анализа с помощью кросс-платформенной справочной правовой системы «Консультант плюс» на уровне решений высших судов за период с 01.01.2016 г. по 31.12.2023 г. с использованием расширенного поиска по ключевым словам «лекарственное обеспечение детей» [5].
Группировку, ранжирование и систематизацию применяли в рамках анализа ассортиментной матрицы лекарственных препаратов для педиатрии. Графический анализ был использован для визуализации данных. Обработка данных осуществлялась с использованием MS Excel 2021.
Результаты и обсуждение
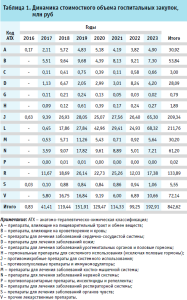
Установлено, что с 2016 по 2023 гг. показатель общего объема госпитальных закупок в рамках анализируемого субъекта составил 842,62 млн руб. При этом в 2023 г. зафиксировано значительное (на 94,36%) увеличение выделения финансовых ресурсов по сравнению с 2022 г., что вполне может быть обосновано организацией закупок на длительный период (табл. 1). Лидерами в стоимостном выражении выступают препараты групп: L – противоопухолевые препараты и иммуномодуляторы; J – противомикробные препараты для системного использования; R – препараты для лечения заболеваний респираторной системы, охватывая 25,13%; 24,84% и 15,89% общей структуры. Примечательно, что в 2023 г. количество электронных заявок также превысило аналогичный показатель 2022 г. на 23,37%. Проведенный анализ ассортимента позволил установить, что группа С – препараты для лечения заболеваний сердечно-сосудистой системы в стоимостном выражении составляет лишь 0,096%, 0,58%, 0,34% интегрального показателя затрат в 2021, 2022, 2023 гг. соответственно. Минимальными величинами характеризуются затраты в отношении противопаразитарных позиций, препаратов для лечения заболеваний урогенитальных органов и препаратов половых гормонов, а также гормональных препаратов для системного использования.
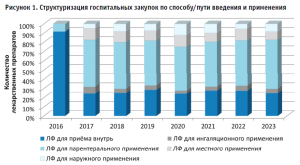
Оценка распределения ассортимента лекарственных препаратов для детей по способу/пути введения и применения позволила выявить категории с наибольшим удельным весом в общей структуре закупок, а именно: парентеральные формы, а также лекарственные формы для приема внутрь, суммарно охватывающие 75,85% ассортиментной матрицы (рис.1).
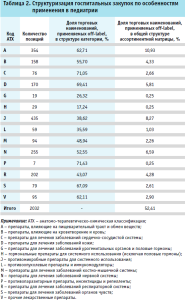
Анализ государственных закупок медицинских стационаров за 2016–2023 гг. по особенностям применения в педиатрии демонстрирует практику потребления лекарственных препаратов «вне инструкции» во всех АТХ-группах на уровне от 17 до 71%. Существенное превалирование off-label-потребления по доле торговых наименований регистрируется в рамках категорий противопаразитарных лекарственных препаратов (71,43%), препаратов для лечения заболеваний сердечно-сосудистой системы (71,05%), препаратов для лечения заболеваний кожи (69,41%), а также препаратов для лечения заболеваний органов чувств (67,09%)%. В общей структуре ассортиментной матрицы доля торговых наименований, применяемых off-label, превышает отметку 52%. (табл. 2).
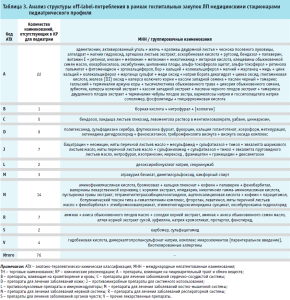
Оценка государственных закупок стационаров педиатрического профиля в преломлении к наличию выявленных off-label-позиций с учетом форм выпуска и дозировок в российских клинических рекомендациях для педиатрии позволяет констатировать, что факт присутствия МНН (группировочных наименований) регистрируется для 80% препаратов категории off-label, что, в свою очередь, подчеркивает проблему отсутствия приемлемых для современной педиатрии детских форм (табл. 3).
Обращает на себя внимание наличие в структуре закупок позиций, отсутствующих в стратегиях медикаментозной терапии детей в преломлении к контенту российских клинических рекомендаций, что свидетельствует о правовых и клинических рисках применения данных ЛП в педиатрии [6]. При этом сравнительно высокие риски регистрируются в категориях лекарственных препаратов, влияющих на пищеварительный тракт и обмен веществ (28,95%), препаратов для лечения заболеваний нервной системы (18,42%), препаратов для лечения заболеваний кожи (11,84%), а также противомикробных препаратов для системного использования (9,21%).
Оценка перспектив развития фармацевтического рынка в анализируемом сегменте с точки зрения текущих, приостановленных, прекращенных и завершенных клинических исследований в детской популяции позволила установить, что на территории Российской Федерации за анализируемый период инициировано 38 клинических исследований, посвященных оценке эффективности и безопасности лекарственных препаратов для педиатрической практики, из которых 63% составляют исследования III фазы [4]. При этом в педиатрии в целом зафиксированы исследования в отношении четырехвалентной менингококковой конъюгированной вакцины, имидазолилэтанамида пентандиовой кислоты, полиметилсилоксана, симетикона, оциллококцинума, далбаванцина, 20-валентной пневмококковой конъюгированной вакцины, аталурена, ибупрофена, панавира (картофеля побегов сумма полисахаридов), парацетамола, вилтоларсена, нусинерсена. На пациентов всех возрастных групп (категория «педиатрия+терапия») ориентирована клиническая оценка эффективности и безопасности интерферона альфа-2b человеческого рекомбинантного, рацекадотрила, домперидона+симетикона, ибупрофена. Примечательно, что максимальное число исследований регистрируется в отношении препаратов, применяемых в детской ревматологии (олокизумаб, тофацитиниб, олумиант, барицитиниб, тоцилизумаб) (рис. 2).
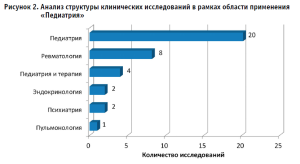
Важно подчеркнуть, что доля исследований в отношении препаратов, разработанных на территории Российской Федерации, составляет лишь 21%, что демонстрирует приоритетную ориентацию российской фарминдустрии на пациентов старше 18 лет, обусловленную сложностью и длительностью фармразработки в области педиатрии и подчеркивает потенциальные риски импортозависимости в ближней и среднесрочной перспективах [7,8].
При этом отсутствует корреляция между динамикой заболеваемости, структурой off-label-потребления и областью применения потенциальных ЛП, что, в свою очередь, нивелирует вероятность решения вопросов применения препаратов «вне инструкции» в педиатрии в условиях современного состояния фармацевтического рынка. Последнее обосновывает необходимость совершенствования механизмов государственного регулирования в части разработки и производства ЛП для детей.
Важно заметить, что отсутствие клинических исследований в отношении препаратов, применяющихся при тяжелых, прогрессирующих жизнеугрожающих заболеваниях и, как следствие, государственной регистрации, обуславливает применение незарегистрированных на территории Российской Федерации лекарственных средств, что формирует судебную практику в части отсутствия жизненно необходимых для ребенка препаратов и незаконного ввоза данных препаратов на территорию России [5].
Заключение
Конвенция о правах ребенка, Конституция Российской Федерации и федеральные законы, включая законы от 24.07.1998 № 124-ФЗ «Об основных гарантиях прав ребенка в Российской Федерации», от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств», предусматривают защиту прав наиболее уязвимой группы населения, что подчеркивает приоритетность вопросов совершенствования лекарственного обеспечения детей.
К сожалению, в рамках рутинной клинической практики, оцениваемой по результатам закупок ЛП медицинскими стационарами педиатрического профиля, регистрируется потребление препаратов off-label на уровне, превышающем отметку 52%, что продиктовано как отсутствием сбалансированности национального ассортиментного портфеля препаратов для педиатрии в части специфичных лекарственных форм и дозировок, так и недостаточным уровнем клинических исследований препаратов в данной возрастной группе. В свою очередь, проведение клинических исследований у несовершеннолетних пациентов осложняется гетерогенностью популяции, специфическими побочными реакциями и затруднениями в определении объективных конечных показателей, обуславливающих специфичность дизайна в педиатрии.
Таким образом, полученные результаты подчеркивают важность разработки регуляторных инициатив, направленных на совершенствование вопросов лекарственного обеспечения детей.
- Немятых О.Д., Ковалева Е.А., Наркевич И.А. Перспективы оптимизации лекарственного обеспечения педиатрических пациентов на основе развития фармацевтического рынка в сегменте лекарственных препаратов для детей // Разработка и регистрация лекарственных средств. – 2024. – Том 13. – № 4. DOI: 10.33380/2305-2066-2024-13-4-1839.
- Государственный реестр лекарственных средств. [Электронный ресурс]. Режим доступа: https://grls.rosminzdrav.ru/Default.aspx (дата обращения: 27.11.2024).
- Единая информационная система в сфере закупок. [Электронный ресурс]. Режим доступа: https://zakupki.gov.ru/epz/main/public/home.html (дата обращения: 27.11.2024).
- Реестр разрешений на проведение клинических исследований. [Электронный ресурс]. Режим доступа: https://grls.rosminzdrav.ru/CIPermitionReg.aspx (дата обращения: 27.11.2024).
- КонсультантПлюс. [Электронный ресурс]. Режим доступа: https://www.consultant.ru (дата обращения: 27.11.2024).
- Министерство здравоохранения Российской Федерации. Рубрикатор клинических рекомендаций. [Электронный ресурс]. Режим доступа: https://cr.minzdrav.gov.ru (дата обращения: 27.11.2024).
- Колбин А.С., Радаева К.С. Дозирование лекарственных средств в педиатрии: возможные подходы // Вопросы современной педиатрии. – 2023. – № 22(4). – С. 289–297. DOI:10.15690/vsp.v22i4.2593.
- Теплова Н.В., Грацианская А.Н., Костылева М.Н. Клинические исследования с участием детей: роль этической экспертизы // Медицинская этика. – 2021. – № 3. – С. 24–30. DOI:10.24075/medet.2021.026.
