ФАРМАКОНАДЗОР
Анализ данных ICSR препаратов биотехнологических белков
1 — ФГБОУ ВО «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.
ORCID: https://orсid.org/0000-0002-4381-9513
2 — ФГБОУ ВО «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.
ORCID: https://orсid.org/0009-0004-7509-7326
3 — ФГБОУ ВО «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 150000, Российская Федерация, г. Ярославль, ул. Революционная, д. 5.
ORCID: https://orсid.org/0000-0001-7847-1679
4 — Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Костромской области, 156000, Российская Федерация, г. Кострома, пр-т Мира, д. 1/2.
В исследовании приведен анализ базы данных нежелательных реакций препаратов биотехнологических белков. Проанализирована база данных регионального центра фармаконадзора Ярославской области. Выявлены основные системно-органные классы нежелательных реакций: «Нарушения со стороны кожи и подкожных тканей», «Общие нарушения и реакции в месте введения». Полученные данные указывают на важность учета нежелательных реакций на лекарственные препараты и передачи информации в систему фармаконадзора, что способствует соблюдению лекарственной безопасности, повышению ответственности и вовлеченности медицинского персонала в развитие фармаконадзора.
Ключевые слова: фармаконадзор, антитела, биотехнологические белки, спонтанные сообщения
Введение
Фармаконадзор – вид деятельности по мониторингу эффективности и безопасности лекарственных препаратов, направленный на выявление, оценку и предотвращение нежелательных реакций (НР) применения лекарственных препаратов (ЛП)1. В современном мире значительна распространенность НР: по данным статистики, на 2019 г. в мире были зарегистрированы до 2 млн НР, из которых более 150 тыс. являлись крайне тяжелыми и имели фатальные последствия. Частота госпитализаций, связанных с развившимися у пациентов НР, в разных странах мира варьируется от 2 до 21%, но при этом значительная доля подобных осложнений лекарственной терапии потенциально являются предотвратимыми [1].
Одной из эффективных систем оценки НР лекарственных препаратов является система регистрации спонтанных сообщений [2]. Экспертами доказано, что в 10–20% случаях применение ЛП может сопровождаться появлением нежелательных реакций у пациентов. При этом в России доля передаваемых отчетом ICSR (Individual Case Safety Report) может составлять не более 20% от реального количества нежелательных реакций, что свидетельствует о необходимости совершенствования организационной работы при осуществлении фармаконадзора [3]. За последние пять лет сообщаемость по Ярославской и Костромской областям имеет тенденцию роста как в отношении числа поступающих сообщений, так и охвата медицинских организаций, внедривших в практическую деятельность выполнение требований по фармаконадзору. В Костромской области лидирующие позиции по числу поступивших сообщений принадлежат иммунобиологическим и антибактериальным лекарственным средствам. По Ярославской области выявлена тенденция роста числа сообщений в отношении лекарственных препаратов биотехнологических белков, получивших широкое применение в онкологии, онкогематологии, ревматологии, иммунологии и кардиологии для лечения тяжелых заболеваний [3].
Разработка методик анализа данных фармаконадзора способствует развитию прогностических возможностей и широкому применению риск-ориентированного подхода при применении технологий здравоохранения.
Материалы и методы
Проверена и проанализирована база данных спонтанных сообщений регионального центра фармаконадзора с точки зрения развития нежелательных реакций (исключены сведения о неэффективности подозреваемого препарата, зарегистрированные ранее как НР), наименования действующего вещества, пути введения лекарственного препарата (ЛП), системно-органного класса (СОК). Классифицированы сведения 40 спонтанных сообщений о 57 нежелательных реакциях, зарегистрированных в Ярославской области с 2019 по 2024 год и связанных с применением препаратов биотехнологических белков.
Исследование проведено на средства регионального гранта «Реализация научных исследований, выполняемых аспирантами под руководством научных руководителей», Министерство социальных коммуникаций и развития некоммерческих организаций Ярославской области (Выписка из Протокола № 3 КК-2024 заседания конкурсной комиссии, г. Ярославль).
Цель исследования
Разработать методику анализа спонтанных сообщений и выявить основные системно-органные классы, подверженные нежелательному воздействию при применении биотехнологических белков, на основе данных регионального центра фармаконадзора Ярославской области.
Результаты исследования и обсуждение результатов
Произведен поиск ICSR в базе данных регионального центра фармаконадзора согласно перечню МНН лекарственных препаратов биотехнологических белков, включенных в приложение 3 Территориальной программы государственных гарантий бесплатного оказания населению Ярославской области медицинской помощи2. Основные данные (наименование НР, МНН, торговое наименование лекарственного препарата, путь введения, доза, год регистрации НР, показание, критерий серьезности и исход) объединены в базу данных исследования. Проведена сверка наименования НР и показания для исключения данных о неэффективности терапии (ранее зарегистрированная НР исключалась из базы данных исследования, если показание и наименование НР совпадали). Для соблюдения корректности наименований НР проведена сверка базы данных исследования и раздела 4.8 «Нежелательные реакции» общей характеристики лекарственного препарата. В случае обнаружения расхождений в подходе к наименованию НР, наименование НР корректировались на основе данных общей характеристики лекарственного препарата (изменения в наименование НР в базе данных исследования).
Каждой НР присваивался системно-органный класс в соответствии с общей характеристикой лекарственного препарата (ОХЛП). Если НР являлась непредвиденной, то проводился поиск по наименованию НР в ОХЛП лекарственных препаратов той же фармако-терапевтической группы для присвоения корректного системно-органного класса.
Перечень спонтанных сообщений о НР был получен от врачей медицинских организаций г. Ярославля: ГБУЗ ЯО «Областная клиническая больница», ГУЗ ЯО «Детская поликлиника № 5», ГБУЗ ЯО «Клиническая больница им. Н.А. Семашко», ГБУЗ ЯО «Клиническая больница № 2»; г. Рыбинска: ГУЗ ЯО «Городская детская больница», ГБУЗ ЯО «Рыбинская городская Больница № 1»; г. Углича: ГУЗ ЯО Угличская ЦРБ; г. Переславль-Залесский: ГБУЗ ЯО «Переславская ЦРБ».
В таблице 1 изложены данные о зарегистрированных в системе спонтанных сообщениях НР. Более половины (53 % ICSR) было получено в связи с развитием НР у пациентов женского пола, 47 % – доля ICSR пациентов мужского пола.
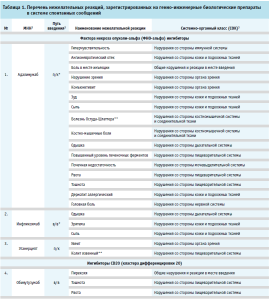
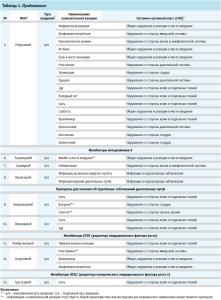
Биологические лекарственные препараты, указанные в таблице 1, применялись по следующим показаниям: ревматоидный артрит, анкилозирующий спондилит, ювенильный идиопатический артрит, спондилоартрит, псориатический артрит, язвенный колит, болезнь Крона, болезнь Бехчета, B-клеточная лимфома, хронический В-клеточный лимфоцитарный лейкоз, рак прямой кишки, рак сигмовидной ободочной кишки, рак легкого, рак молочной железы и бронхиальная астма.
Учитывая гетерогенность исследуемых видов терапии (по показаниям, числу спонтанных сообщений), была оценена структура СОК биологической терапии в целом по результатам базы данных спонтанных сообщений для 13 МНН биотехнологических белков (табл. 2).
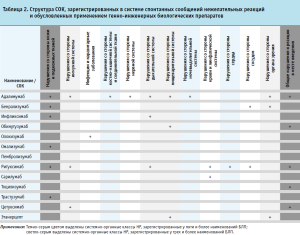
Наибольшее число нежелательных реакций было связано с нарушениями со стороны кожи и подкожных тканей (30 %), общими нарушениями и реакциями в месте введения (12 %), нарушениями со стороны зрения (9 %) и органов дыхания (9 %). Серьезные нежелательные реакции проявлялись в развитии ангионевротического отека (адалимумаб, Эксэмптия®), инфузионных реакций (ритуксимаб, Ацеллбия®), анафилактического шока (ритуксимаб, Реддитукс®; цетуксимаб, Эрбитукс) и отеком Квинке (цетуксимаб, Эрбитукс). Серьезные нежелательные реакции, как правило, относились к нарушениям со стороны иммунной системы. Зарегистрирована одна серьезная непредвиденная нежелательная реакция – слепота (бенрализумаб, п/к путь введения).
Выводы
Основными СОК, подверженными развитию нежелательных реакций в ответ на применение биотехнологических белков, являются «Нарушения со стороны кожи и подкожных тканей» (НР сыпь, зуд), «Общие нарушения и реакции в месте введения» (НР инфузионная реакция, анафилактический шок). Также значительное число НР зарегистрировано в СОК «Нарушения со стороны иммунной системы», «Нарушения со стороны дыхательной системы», «Нарушения со стороны пищеварительной системы» и «Нарушения со стороны органа зрения». Наибольшее число нежелательных реакций было связано с нарушениями со стороны кожи и подкожных тканей, общими нарушениями и реакциями в месте введения, нарушениями со стороны зрения и органов дыхания.
Для наименований биотехнологических белков «адалимумаб», «этанерцепт», «тоцилизумаб», «бенрализумаб» и «цетуксимаб» выявлены НР, ранее не указанные в общей характеристике лекарственного препарата или инструкции для медицинского применения. Зарегистрирована одна серьезная непредвиденная нежелательная реакция – слепота (бенрализумаб, п/к путь введения). Проведенное исследование подтверждает важность выявления нежелательных реакций при применении ЛП с соблюдением механизма передачи данных в системе фармаконадзора. Анализ и обобщение получаемых сведений о действии лекарственных препаратов создает основу лекарственной безопасности, способствует повышению ответственности и вовлеченности медицинского сообщества в развитие фармаконадзора.
______________________________________________________________________
1 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». URL: https://normativ.kontur.ru/document?moduleId=1&documentId=489959.
2 Постановление Правительства Ярославской области от 29.12.2023 № 1451-п «О Территориальной программе государственных гарантий бесплатного оказания населению Ярославской области медицинской помощи на 2024 год и на плановый период 2025 и 2026 годов».
3 Государственный реестр лекарственных средств. URL: https://grls.minzdrav.gov.ru/default.aspx.
- Литвиненко Т.С., Полинская Т.А., Шишов М.А., Сафроненко А.В., Ганцгорн Е.В. Фармаконадзор: фокус на анализ спонтанных сообщений // Южно-Российский журнал терапевтической практики. 2023; 4(1): 46–52. DOI:10.21886/2712-8156-2023-4-1-46-52.
- Литвиненко Т.С., Сафроненко А.В., Макляков Ю.С., Ганцгорн Е.В., Постникова Е.С., Гайсаев М.О., Брижак В.Г. Анализ спонтанных сообщений как «инструмент» фармаконадзора // Биомедицина. 2022. № 2. URL: https://cyberleninka.ru/article/n/analiz-spontannyh-soobscheniy-kak-instrument-farmakonadzora [дата обращения: 25.03.2025].
- Крашенинников А.Е. Автореферат на соискание ст. доктора фарм. наук «Совершенствование фармаконадзора на основе государственных и гражданских институтов контроля за качеством лекарственных средств в Российской Федерации», Пермь, 2020.
