ОБРАЩЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Актуальные вопросы фармаконадзора в деятельности медицинских организаций (на примере Ростовской области)
1 — Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Ростовской области, 344037, Российская Федерация, г. Ростов-На-Дону, ул. Ченцова, д. 71в / 63в.
2 — Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Ростовской области, 344037, Российская Федерация, г. Ростов-На-Дону, ул. Ченцова, д. 71в / 63в.
В статье представлен опыт реализации требований законодательства к предоставлению информации о безопасности и эффективности лекарственных препаратов на территории Ростовской области. Приведены и проанализированы соответствующие показатели «сообщаемости» в рамках фармаконадзора за период с 2019 года по первый квадриместр 2022 года. Предложены общие направления по повышению эффективности фармаконадзора.
Ключевые слова: фармаконадзор, спонтанные сообщения, искусственный интеллект
Применение лекарственных препаратов всегда сопряжено с потенциальными рисками недостаточной безопасности и эффективности, а также риском полипрагмазии, учитывая множество вариантов взаимодействия лекарственных средств между собой и их проявлений в патологически измененных органах и системах. В целях минимизации рисков вопросам фармаконадзора уделяется пристальное внимание как в нашей стране, так и на международном уровне. Всемирной организацией здравоохранения, Евразийским экономическим союзом созданы специальные программы мониторинга безопасности лекарственных препаратов. Основным международным методом мониторинга безопасности и эффективности лекарственных препаратов служит метод спонтанных сообщений. В субъектах Российской Федерации частота спонтанных сообщений, рассчитываемая на 100 тысяч населения, достаточно широко варьирует [1].
С учетом вышеизложенного, целью настоящей статьи является анализ результатов сообщаемости информации о безопасности применения лекарственных препаратов медицинскими работниками Ростовской области с учетом сведений, внесенных в автоматизированную информационную систему Росздравнадзора – национальную базу данных «Фармаконадзор»1.
Требования к медицинским работникам в контексте обязанности информирования о недостаточной безопасности и/или эффективности лекарственных препаратов установлены целым рядом нормативных правовых актов:
- Соглашением о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза2;
- Решением Совета Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей практики фармаконадзора Евразийского экономического союза»;
- Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (статья 73);
- Федеральным законом от 12.05.2010 № 61-ФЗ «Об обращении лекарственных средств» (статья 64);
- приказом Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора».
Дополнительно Росздравнадзором неоднократно направлялись информационные письма с разъяснениями о порядке осуществления и организации фармаконадзора на уровне медицинских организаций.
Одним из показателей для оценки эффективности фармаконадзора, как уже было отмечено выше, служит анализ сообщаемости информации о безопасности применения лекарственных препаратов.
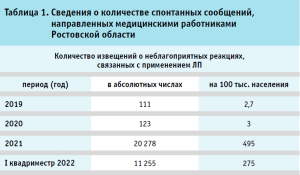
В частности, в Ростовской области за период с 2019 года по первый квадриместр 2022 года наблюдался значительный рост данных сообщений (табл. 1).
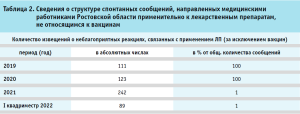
В тоже время, анализ структуры сообщений, внесенных в автоматизированную информационную систему Росздравнадзора – национальную базу данных «Фармаконадзор», свидетельствует о пропорциональном росте сообщений, связанных с применением вакцин (табл. 2).
При более детальном анализе установлено, что основание направления значительной части спонтанных сообщений, связанных с применением вакцин, формально – наличие заболевания новой коронавирусной инфекцией и проведение соответствующей вакцинации в анамнезе.
Действительно, пунктом 7.1.6.4 «Правил надлежащей практики фармаконадзора Евразийского экономического союза», утвержденных Решением Совета Евразийской экономической комиссии от 03.11.2016 № 87, предусмотрено, что репортированию подлежат случаи отсутствия эффективности подозреваемого лекарственного препарата – вакцины, с целью выделения потенциальных сигналов о сниженной иммуногенности в подгруппе вакцин, сниженном иммунитете или замещении штамма. Формальный подход к исполнению данной нормы представляется необоснованным и искажающим объективную картину о безопасности и/или эффективности вакцин. Тем более, что положениями пункта 36 Порядка осуществления фармаконадзора, утвержденного приказом Росздравнадзора от 15.02.2017 № 1071, отдельно предусмотрено, что важнейшим аспектом в рассматриваемой ситуации является отсутствие индивидуальных особенностей пациента и (или) специфики его заболевания, влияющих на клинический эффект.
Вышеизложенное свидетельствует о двух разнонаправленных тенденциях в состоянии современного здравоохранения. С одной стороны, к сожалению, можно констатировать недостаточную информированность и неготовность медицинских работников нести ответственность за формальное исполнение обязанностей, связанных с фармаконадзором. С другой стороны, внедрение информационных технологий в деятельность Росздравнадзора (формирование автоматизированной информационной системы), а также широкое применение профилактических мероприятий в осуществлении контрольно-надзорных полномочий, позволило кардинально улучшить процессы направления, регистрации и анализа спонтанных сообщений, что в конечном итоге положительно отрази лось на его эффективности в целом.
Безусловно, сам механизм направления спонтанных сообщений, предусматривающий определенную «свободу усмотрения» со стороны лечащего врача в условиях процессов внедрения информатизации здравоохранения, требует обсуждения со стороны профессионального сообщества и, возможно, пересмотра. В данном контексте следующим качественно новым этапом является применение автоматизированных средств идентификации лекарственных препаратов в практике фармаконадзора [1]. В настоящее время сфера здравоохранения стоит на пороге широкого применения искусственного интеллекта: активно формируются доступные для обработки и анализа сведения как о пролеченных случаях, так и о примененных лекарственных препаратах. Многотысячная номенклатура лекарственных средств, а также потенциальные негативные аспекты полипрагмазии обуславливают необходимость перехода к цифровизации процессов, позволяющей автоматически осуществлять мониторинг безопасности и эффективности лекарственных препаратов в режиме реального времени. В настоящее время все необходимые предпосылки сформированы, при этом активная роль Федеральной службы по надзору в сфере здравоохранения по формированию соответствующей информационной среды уже сейчас позволяет внедрять принципы «умного контроля» в сфере фармаконадзора.
_______________________________________________________________________
1 URL: https://roszdravnadzor.gov.ru/services/npr_ais?
2 Федеральный закон от 31.01.2016 № 5-ФЗ «О ратификации Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза». URL: http://www.kremlin.ru/acts/bank/40479.
- Мурашко М.А. Использование средств идентификации лекарственных препаратов в практике фармаконадзора / М.А. Мурашко, А.В. Самойлова, С.В. Глаголев, Д.В. Пархоменко [и др.] // Вестник Росздравнадзора. – 2020. – № 5-1. – С. 6–9.
- Кудрявцева Е.М. Проведение фармаконадзора в медицинских организациях / Е.М. Кудрявцева, К.В. Горелов // Вестник Росздравнадзора. – 2021. – № 2. – С. 53–57.
