МЕЖДУНАРОДНОЕ СОТРУДНИЧЕСТВО
Фармакопея Евразийского экономического союза: испытания, методики и требования
1 — РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Министерства здравоохранения Республики Казахстан. 010000, Республика Казахстан, г. Нур-Султан, ул. Бауыржана Момышулы, д. 2/3.
Фармакопея ЕАЭС, устанавливая критерии доступа лекарственных средств по качеству на общий рынок, является основополагающим документом, необходимым для регистрации ЛС в рамках ЕАЭС. Она гармонизирована с требованиями фармакопей государств-членов ЕАЭС и основных фармакопей мира. В статье рассмотрены структура Фармакопеи ЕАЭС, фармакопейные требования и указания, характер фармакопейных статей. Приведены особенности фармакопейных испытаний и методик, критерии приемлемости показателей качества лекарственных средств. Раскрыто понятие «фармакопейное качество».
Ключевые слова: фармакопея ЕАЭС, фармакопейная статья, испытания, методики, требования, фармакопейное качество
Введение
В соответствии с Договором о Евразийском экономическом союзе1 и Соглашением о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза2, Фармакопея Евразийского экономического союза (ЕАЭС) является важнейшим звеном в системе регулирования обращения лекарственных средств (ЛС) на общем рынке.
Фармакопея ЕАЭС представляет собой свод региональных требований и положений, устанавливающих предельный допустимый уровень качества ЛС на фармацевтическом рынке ЕАЭС. Ее требования и положения распространяются на ЛС как для медицинского, так и ветеринарного применения, обращающиеся на общем рынке. Фармакопея регламентирует требования к качеству и упаковке ЛС, вспомогательных веществ и материалов, испытаниям и методам их проведения, а также используемым реактивам.
Фармакопея ЕАЭС гармонизирована с требованиями национальных фармакопей государств-членов ЕАЭС (Государственной фармакопеи Республики Беларусь, Государственной фармакопеи Республики Казахстан и Государственной фармакопеи Российской Федерации) и основных фармакопей мира (Европейской фармакопеи, Фармакопеи США и Британской фармакопеи). Гармонизация фармакопейных требований к ЛС в рамках ЕАЭС и основные подходы к ее осуществлению определены Концепцией гармонизации фармакопей государств-членов ЕАЭС3.
Структура Фармакопеи ЕАЭС
Фармакопея ЕАЭС включает следующие фармакопейные тексты:
- общие сведения;
- общие фармакопейные статьи;
- частные фармакопейные статьи;
- приложения.
Несмотря на тесную взаимосвязь и неразрывность, фармакопейные тексты имеют различную степень приоритетности требований, которая определяет следующую их иерархию: приложения общие сведения общие фармакопейные статьи частные фармакопейные статьи.
Фармакопейные статьи имеют обязательный, рекомендательный и информационный характер. Например, общие фармакопейные статьи «Однородность дозированных единиц», «Остаточные органические растворители», «Контроль примесей в субстанциях для фармацевтического применения» и др. носят обязательный характер. Рекомендательный характер имеют общие фармакопейные статьи «Рекомендации по проведению испытания на растворение», «Верификация фармакопейных методик», «Трансфер аналитических методик» и др. Общие фармакопейные статьи «Кристалличность», «Раздел “Свойства” в частных фармакопейных статьях на субстанции для фармацевтического применения», «Функциональные характеристики вспомогательных веществ» и др. приводятся исключительно с информационной целью. Характер фармакопейных требований и положений может указываться в разделе 1 «Общие сведения» Фармакопеи ЕАЭС или вводной части общей фармакопейной статьи, а также непосредственно в тексте фармакопейной статьи, например, в разделе «Испытания».
Фармакопейные требования и указания
Требования Фармакопеи ЕАЭС должны неукоснительно выполняться. Необходимость соответствия этим требованиям не исключает ни одно из условий:
- ни улучшенный подход к контролю качества ЛС;
- ни применение процессно-аналитической технологии (ПАТ);
- ни проведение испытаний при выпуске в режиме реального времени и др.
Фармакопейные требования характеризуются определенными особенностями. Они могут не быть исчерпывающими, а дополняться требованиями производителя и (или) уполномоченного органа, например, в отношении испытаний, условий их проведения, критериев приемлемости и т.д. При этом они должны выполняться на всем протяжении срока годности лекарственных препаратов, периода повторного контроля субстанций для фармацевтического применения, периода использования упаковочных материалов. Требования фармакопеи не распространяются на ЛС во вскрытой упаковке.
Фармакопейные указания могут выражаться в разнообразных формах, однако наиболее часто используются следующие:
- при отсутствии других указаний в частной фармакопейной статье;
- при отсутствии обоснования и разрешения уполномоченного органа.
Первое указание означает, что требования общих фармакопейных статей должны быть выполнены, если только в эти требования не внесены изменения или исключения, указанные в частной фармакопейной статье. Следует заметить, что данное указание отражает приоритетность частных фармакопейных статей в сравнении с другими фармакопейными текстами.
Второе указание регламентирует выполнение требований общих и частных фармакопейных статей, если только по разрешению уполномоченного органа в эти требования не внесены изменения или исключения, обоснованные для конкретного случая. Разрешенные изменения или исключения обычно включаются в нормативный документ по качеству лекарственного препарата.
Выражения «пригодный» или «подходящий», применяемые в фармакопейных текстах к реактивам, методикам, микроорганизмам и т.п. требуют подтверждения их пригодности перед уполномоченным органом при отсутствии таких критериев в общих и частных фармакопейных статьях. Часто используемое выражение «следует» указывает на рекомендательный характер фармакопейных положений.
Испытания и методики испытаний
Фармакопейные испытания обычно представлены в разделе «Испытания» фармакопейных статей и предназначены для контроля качества готовой продукции. Наряду с этим ряд испытаний может включаться в раздел «Особенности технологии» (или «Производство»), что предполагает их выполнение исключительно производителем, в особенности, если испытание представляется технически сложным для общего пользования, или не применимо к контролю готовой продукции, или если валидация производственного процесса обеспечивает достаточный контроль готовой продукции.
Фармакопейные методики испытаний делятся на общие, альтернативные и гибкие. Общая фармакопейная методика по сути является единой методикой для всех рассматриваемых случаев, имеет единые критерии приемлемости для показателей качества и единые критерии пригодности системы. Альтернативные методики являются взаимозаменяемыми, имеют единые критерии приемлемости для показателей качества, обеспечивают возможность принятия однозначного решения о соответствии ЛС требованиям общих и частных фармакопейных статей.
Понятие гибких методик появилось сравнительно недавно в рамках используемого в ведущих фармакопеях мира подхода гибкости, но уже активно используется в частных монографиях Фармакопеи США. Обоснованием введения гибких методик в фармакопее послужили следующие факторы:
- различный профиль примесей в активных фармацевтических субстанциях ввиду различных путей их синтеза;
- различное содержание кристаллизационной воды (растворителей) в активных фармацевтических субстанциях;
- существование различных полиморфных модификаций активной фармацевтической субстанции;
- различный состав лекарственных препаратов-аналогов;
- различные лекарственные формы, содержащие одно и то же действующее вещество и др.
Гибкие методики являются дополнительными, но не взаимозаменяемыми. Они не обеспечивают получение эквивалентных результатов по ЛС. Такие методики включаются в частную фармакопейную статью лишь при документальном подтверждении того, что общая методика испытания не пригодна для ряда фармацевтических субстанций и лекарственных препаратов, находящихся в обращении на фармацевтическом рынке страны или региона сбыта. Обычно гибкие методики и соответствующие им критерии приемлемости могут приводиться для одного показателя качества в частной фармакопейной статье. Только релевантные методики, учитывающие указанные выше различия, могут объективно оценивать качество ЛС, в отличие от общих (единых) методик. Особое значение гибкие методики испытаний приобретают для биологических ЛС.
Любая методика, предназначенная для аналитических целей, должна быть валидирована. Все аналитические методики, приводимые в фармакопеях, являются валидированными, поэтому пользователям фармакопейных методик не нужно проводить их валидацию. Однако пользователям необходимо установить и документально отразить пригодность фармакопейных методик в реальных условиях испытания данного ЛС, то есть провести их верификацию. Верификация фармакопейных методик должна проводиться в соответствии с требованиями и положениями общей фармакопейной статьи «Верификация фармакопейных методик», предусматриваемой к включению в часть 2 тома I Фармакопеи ЕАЭС. Результаты верификации должны быть представлены в регистрационных досье лекарственных препаратов.
В процессе верификации фармакопейных методик часто становится необходимым внести определенные изменения, то есть адаптировать фармакопейную методику к реальным условиям ее применения к испытуемому ЛС. Например, для методик жидкостной хроматографии может потребоваться изменить размеры колонки (длину, внутренний диаметр), или размер частиц сорбента, или температуру колонки, или скорость подвижной фазы. С другой стороны, чрезмерная адаптация фармакопейной методики может потребовать ее валидации (частичной или даже полной в зависимости от степени вносимых изменений). До каких пределов может осуществляться адаптация методики, чтобы по-прежнему считать ее фармакопейной и избежать валидации? В качестве примера в таблицах 1 и 2 приведены допустимые пределы адаптации хроматографических методик, соответствующие требованиям общей фармакопейной статьи «Хроматографические методы разделения» Фармакопеи ЕАЭС.
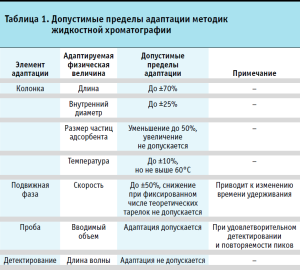
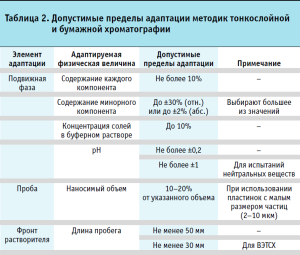
Критерии приемлемости показателей качества
Критерии приемлемости показателей качества ЛС, регламентируемые Фармакопеей ЕАЭС, прежде всего основаны на требованиях безопасности и эффективности ЛС. Они должны учитывать диапазоны вариабельности аналитической методики (погрешности) и вариабельности процесса производства ЛС.
Установление критериев приемлемости осуществляется на основе результатов испытаний серийной продукции, предоставленных производителями, и данных, полученных в ходе разработки частных фармакопейных статей испытательными лабораториями. Для некоторых отдельных испытаний, например, «Потеря в массе при высушивании», «Вода» и др., они могут устанавливаться с помощью эмпирического правила «3-сигма». Следует отметить, что данное правило может оказаться неприемлемым для других испытаний, например, для испытания «Родственные примеси».
Поскольку Фармакопея ЕАЭС регламентирует предельный допустимый уровень качества ЛС, критерии приемлемости показателей качества, устанавливаемые производителем и отражаемые в спецификациях качества ЛС, должны быть не ниже фармакопейных норм.
Стандартные образцы Фармакопеи ЕАЭС
Требования Фармакопеи ЕАЭС, как и любой другой фармакопеи, обеспечиваются применением соответствующих стандартных образцов. В качестве стандартных образцов Фармакопеи ЕАЭС принимаются стандартные образцы фармакопей, с которыми гармонизирована Фармакопея ЕАЭС.
В настоящее время Фармакопейным комитетом ЕАЭС разработана и одобрена общая фармакопейная статья Фармакопеи ЕАЭС «Стандартные образцы», предполагаемая к включению во 2 часть I тома Фармакопеи ЕАЭС. В приложении к каждому выпуску Фармакопеи ЕАЭС предусматривается включение Перечня стандартных образцов Фармакопеи ЕАЭС, применяемых в фармакопейных статьях данного выпуска, который представлен в виде таблицы.
В таблице 3 в качестве примера приведено несколько стандартных образцов Фармакопеи ЕАЭС. Как видно из представленных данных, стандартному образцу Фармакопеи ЕАЭС (СО ФЕАЭС) соответствует стандартный образец принятой фармакопеи (например, Ph. Eur. CRS), который использован в фармакопейной статье Фармакопеи ЕАЭС под соответствующим номером и названием. По мере выпуска последующих частей и томов Фармакопеи ЕАЭС предусматривается пополнение данного перечня.
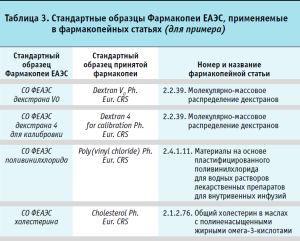
Стандартные образцы Фармакопеи ЕАЭС должны применяться в соответствии с назначением, указанным в фармакопейных статьях Фармакопеи ЕАЭС. Если стандартный образец предполагается использовать для целей, отличных от тех, для которых были установлены его свойства, его пригодность должна быть доказана и полностью описана в регистрационном досье лекарственного препарата.
Фармакопейное качество
Соответствие требованиям Фармакопеи ЕАЭС находит свое выражение в установлении статуса «фармакопейное качество». Субстанция для фармацевтического применения, или лекарственный препарат, или упаковочный материал считаются соответствующими фармакопейному качеству лишь при их соответствии всем требованиям общих и частных фармакопейных статей. Однако указанный статус не требует выполнения производителем всех испытаний, описанных в частной фармакопейной статье, при оценке соответствия фармакопейным требованиям до выпуска ЛС в обращение. Уверенность производителя в фармакопейном качестве ЛС должна быть основана на следующих факторах:
- данных надлежащей разработки ЛС;
- стратегии контроля качества ЛС, основанной на оценке рисков;
- данных валидации процесса производства ЛС;
- ежегодных обзорах качества ЛС.
Утверждение и введение в действие Фармакопеи ЕАЭС
Фармакопея ЕАЭС утверждается и вводится в действие Решением Коллегии Евразийской экономической комиссии. Часть 1 тома I Фармакопеи утверждена 11 августа 2020 года (решение № 100) и введена в действие с 01 марта 2021 года4.
Утверждение фармакопеи обязывает заявителей (производителей), зарегистрировавших лекарственные препараты по правилам ЕАЭС, внести изменения в регистрационные досье до 01 января 2026 года. Все вновь подаваемые заявления на регистрацию с 01 марта 2021 года должны содержать в спецификациях модуля 3 регистрационного досье и нормативных документах по качеству лекарственного препарата ссылки на Фармакопею ЕАЭС. Изменения касаются общих требований к испытаниям, методам их проведения и используемым реактивам.
Заключение
Устанавливая критерии доступа ЛС по качеству на общий рынок, Фармакопея ЕАЭС является основополагающим документом, необходимым для регистрации ЛС в рамках ЕАЭС. Фармакопейные критерии приемлемости показателей качества ЛС основаны на требованиях безопасности и эффективности ЛС. Критерии приемлемости, устанавливаемые производителем в спецификациях качества ЛС, должны быть не ниже фармакопейных норм. Статус «фармакопейное качество» предусматривает соответствие всем требованиям фармакопеи, но не обязывает производителя выполнять все испытания, описанные в частной фармакопейной статье.
_______________________________________________________________________
1 Договор о Евразийском экономическом союзе от 29.06.2014 (ст. 30, 56).
2 Соглашение о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 12.2014 (ст. 5).
3 Концепция гармонизации фармакопей государств-членов Евразийского экономического союза // Решение Коллегии Евразийской экономической комиссии № 119 от 22.09.2015.
4 Фармакопея Евразийского экономического союза. – М., 2020. – Том I, часть 1.
