ЛАБОРАТОРНЫЙ КОНТРОЛЬ
Испытание IVRT – метод оценки качества лекарственных форм: понятия, требования и современные подходы к реализации исследований
1 — ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4. стр.1.
ORCID: https://orcid.org/0000-0002-9667-1014
2 — ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4. стр.1.
markelovmy@fgu.ru
ORCID: https://orcid.org/0000-0002-7212-338X
3 — ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Федеральной службы по надзору в сфере здравоохранения, 109012, Российская Федерация, г. Москва, Славянская площадь, д. 4. стр.1.
ORCID: https://orcid.org/0000-0001-5015-6992
Эффективность лекарственного препарата для местного применения может оцениваться путем измерения скорости и степени высвобождения лекарственного средства из лекарственной формы, поскольку только после высвобождения оно может диффундировать в кожу, которая является целевым участком проникновения. Измерение скорости высвобождения лекарственного средства из местных дерматологических средств может быть достигнуто с помощью теста высвобождения in vitro (IVRT). В статье рассматривается современный подход к проведению исследований методом IVRT, соответствующий требованиям Евразийского экономического союза (ЕАЭС), а также приведены примеры выбора целевых мембран для проведения испытания.
Ключевые слова: испытание in vitro (IVRT), скорость диффузии, мембрана, валидация процесса, трансдермальные методы доставки
Испытание in vitro (In Vitro Release Testing – IVRT) является важным методом для оценки качества лекарственных форм, особенно топических препаратов, таких как кремы, гели и мази. Этот метод позволяет оценить скорость высвобождения активного вещества из лекарственной формы и его проникновение через кожу. Данный метод, очевидно, нужно рассматривать как альтернативный подход для демонстрации биоэквивалентности (BE) лекарственных средств для местного применения.
В фармакопее Евразийского экономического союза (ЕАЭС) IVRT-тест используется для определения скорости и степени высвобождения активного компонента из лекарственной формы в условиях, максимально приближенных к физиологическим. IVRT возможно применить при разработке дженериков для местного применения в качестве общепринятого метода сравнения с продуктами брендов, а также для определения рабочих характеристик нескольких прототипов лекарственных препаратов в качестве инструмента скрининга.
IVRT служит ценным инструментом для демонстрации сравнительных показателей высвобождения лекарственных средств in vitro между тестируемыми и эталонными препаратами. IVRT не имеет эмпирической зависимости с биодоступностью или биоэквивалентностью in vivo и не может служить основанием для прогноза эффективности лекарственной формы. Однако скорость высвобождения действующего вещества является критическим показателем качества, который напрямую влияет на свойства лекарственной формы. Этот показатель следует указывать в спецификации на выпуск и на конец срока годности готового лекарственного препарата.
Тест IVRT основан на принципе диффузии через мембрану. Лекарственная форма помещается в донорный отсек, отделенный от принимающего отсека мембраной. Растворитель из донорного отсека диффундирует через мембрану в принимающий отсек, перенося растворенное лекарственное вещество (действующее вещество).
Скорость диффундирования растворенного вещества определяется первым законом Фика и зависит от площади поверхности диффузионной мембраны, разницы концентраций между двумя областями, расстояния, на которое происходит диффузия, температуры, вязкости растворителя, химической структуры молекул и свойств ДВ, строения и свойств мембраны. Гидрофобные мембраны имеют аффинность к гидрофобным веществам и отталкивают воду. Они пропускают газы и жидкости, которые не растворяются в воде, при этом задерживая воду и другие гидрофильные вещества.
С другой стороны, гидрофильные мембраны обладают аффинностью к воде и пропускают ее, одновременно задерживая гидрофобные вещества.
В тесте IVRT могут использоваться различные типы мембран, которые представляют собой материалы, отчасти имитирующие кожу. К наиболее распространенным для теста IVRT относятся мембраны из силикона, коллагена и поликарбонатные мембраны.
Использование разнообразных типов мембран для теста IVRT позволяет исследователям проводить более точные и разносторонние исследования, а также сравнивать результаты на различных моделях. Каждый тип мембраны имеет свои особенности и преимущества, и выбор оптимального варианта зависит от специфики и целей конкретного исследования.
Перед началом разработки метода IVRT производителю лекарственной формы или исследовательской организации необходимо установить параметры теста:
- мембрана (низкое связывание лекарственного средства, устойчивость к диффузии и химическая устойчивость к рецепторному раствору);
- дозировка продукта (решающее значение имеет последовательный и проверенный метод нанесения препарата на мембрану. Количество наносимого препарата должно быть одинаковым для всех образцов с отклонениями не более +/-5%. Это обеспечивает «псевдобесконечный» режим дозирования и сводит к минимуму эффект испарения);
- достаточная скорость перемешивания (которая не должна приводить к изменению на границе с мембраной и принимающей среды), что может повлиять на диффузию;
- концентрация действующего вещества (если его слишком мало, лекарственное средство в принимающем растворе может не определяться);
- время отбора проб (первая проба должна быть взята после того, как диффузионная ячейка достигнет устойчивого состояния диффузии, учитывая время задержки, а последняя проба должна быть взята во время устойчивого состояния до того, как произойдет чрезмерное истощение лекарственной формы от действующего вещества);
- принимающая (рецепторная) среда (достаточная растворимость и стабильность лекарственного средства в принимающей среде);
- аналитические методы (для точного определения количества активного ингредиента в получаемом растворе в различные моменты времени необходимы чувствительные, проверенные аналитические методы);
- вид аппарата IVRT (вертикальная диффузионная ячейка Франца (рис. 1) или иная).
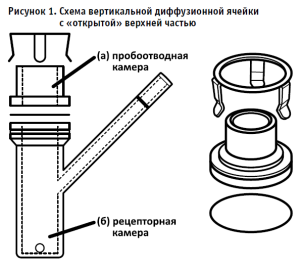
Можно выделить две основные классификации ячеек: по типу исследуемого образца покрова и по типу нагрева. В зависимости от типа исследуемого образца покрова используют различные конфигурации ячеек:
- вертикальная для мембраны с плоской подложкой;
- вертикальная для «роговицы глаза» сферической формы с открытым верхом для, например, дневных глазных капель;
- горизонтальная для «роговицы глаза» сферической формы с закрытой ячейкой для лекарственного препарата;
- горизонтальная с плоским фланцем и закрытой ячейкой для лекарственного препарата для изучения его проникновения через стенки ЖКТ;
- вертикальная с полукруглой подложкой для ногтевых пластин и др.
Существуют также ячейки с дополнительным датчиком температуры в примембранной области, что позволяет изучать согревающие или охлаждающие лекарственные препараты.
Нагрев ячейки осуществляется для имитации температуры человеческого тела, поэтому в большинстве случаев рабочая температура составляет порядка +37°С.
В настоящее время твердотельный нагрев почти полностью вытеснил жидкостной, т.к. стоит меньше и является более надежным.
Без валидации метода IVRT полученные результаты могут быть неточными и ненадежными. Для получения значимых выводов необходимо убедиться, что метод и оборудование обладают необходимой сегрегационной способностью для точного определения «одинаковости» средств местного применения.
Приступая к валидации метода IVRT необходимо учитывать требования «Руководства по валидации аналитических методик по проведению испытаний лекарственных средств», утвержденной решением коллегии Евразийской экономической комиссии от 17.07.2018 № 113. Компоненты валидации:
- Линейность и диапазон измерений – показывает, насколько хорошо зависимость между концентрацией действующего вещества и величиной аналитического сигнала (например, оптическая плотность) соответствует линейной модели в заданном диапазоне концентраций. Диапазон измерений – это область концентраций, в которой метод демонстрирует линейность и точность. Важно определить, насколько широкий диапазон концентраций может быть точно определен методом.
- Точность и воспроизводимость: точность отражает близость измеренных значений к истинному значению действующего вещества. Воспроизводимость определяет, насколько близки друг к другу результаты, полученные при многократных измерениях одной и той же пробы.
Можно выделить три вида точности:
а) систематическая точность (смещение) – показывает, насколько измеренные значения систематически отклоняются от истинного значения;
б) случайная точность (разброс) – отражает случайные отклонения измеренных значений от истинного значения;
в) общая точность сочетает в себе влияние систематических и случайных ошибок.
- Восстановление, баланс массы и уменьшение дозы: восстановление – это способность метода количественно определить действующее вещество, добавленное в матрицу образца. Баланс массы учитывает все компоненты образца. Он позволяет проверить, что метод не упускает из виду важные компоненты образца. Уменьшение дозы – это процедура, используемая для проверки того, что метод точно определяет действующее вещество в образцах с разными концентрациями.
- Чувствительность и специфичность: чувствительность – это способность метода обнаруживать минимальное количество действующего вещества в испытуемом образце; специфичность – способность метода выявлять только конкретное действующее вещество без влияния других компонентов образца.
- Селективность – способность метода различать разные компоненты образца. Это важно, когда в образце присутствуют составляющие, которые могут мешать определению действующего вещества.
- Промежуточная прецизионность: промежуточная прецизионность оценивает вариабельность результатов, полученных при проведении анализа в разных условиях (разное оборудование, реактивы, разные операторы). Критерий приемлемости: CV (коэффициент вариации) < 10%.
- Инертность мембраны (низкое связывание лекарственного средства, устойчивость к диффузии и химическая совместимость с принимающим раствором).
- Растворимость действующего вещества в растворе.
- Квалификация оборудования (этот параметр включает емкость ячейки и внутренний диаметр, поддержание температуры, скорость перемешивания и объем выдаваемого образца, а также параметры окружающей среды.
- Валидация аналитического метода – это важный шаг для обеспечения достоверности и точности полученных результатов. Она гарантирует, что метод соответствует установленным стандартам и пригоден для решения конкретной аналитической задачи.
Неопределенность метода IVRT может возникать из-за различий в процедурах подготовки образцов, температурных условий, выбора рецептуры и других факторов. Для уменьшения неопределенности метода важно соблюдать стандартизированные процедуры, калибровать оборудование и контролировать условия эксперимента.
Построение графиков неопределенности метода IVRT может отражать различные параметры, такие как стандартное отклонение, доверительные интервалы и другие статистические показатели, позволяющие оценить степень неопределенности результатов.
В финале исследований разработчик должен представить:
- отчет о разработке метода IVPT;
- отчет(протокол) о валидации метода IVPT;
- отчет(протокол) об основном исследовании IVPT.
В процессе исследования эквивалентности проводятся тщательные сравнения между исследуемым препаратом и препаратом-референтом. Важно, чтобы сравнение включало также негативный контроль. Под негативным контролем подразумевается использование лекарственной формы, содержащей 50%-ную дозировку исследуемого препарата и обладающей аналогичными фармацевтико-технологическими характеристиками. Это позволяет более точно оценить, насколько измененная формула влияет на кинетику проникновения действующего вещества в дермальные слои кожи.
Данные испытания имеют критическое значение для разработки трансдермальных систем доставки. Они помогают разработчикам учитывать все аспекты, влияющие на эффективность и безопасность препаратов.
Практическая часть
Поскольку на начальном этапе проведения исследования IVPT необходимо обосновать вид выбранной мембраны, в данной работе было проведено сравнительное исследование некоторых доступных коммерческих мембран с целью установления возможности их использования для оценки скорости диффузии на примере модельного действующего вещества (диклофенака) и последующего выбора наиболее оптимальных образцов мембран. Диклофенак – достаточно распространенное НПВС, обладающее «сбалансированной» совокупностью строения и свойств: в составе молекулы имеет как гидрофобные, так и гидрофильные группы атомов (коэффициент распределения «октанол/вода» (logP) 4,4), хорошо растворим в метаноле, растворим в этаноле, практически нерастворим в хлороформе, рКа порядка 4,2 (что обеспечивает его нахождение в неонизированном состоянии в составе кремов и гелей, имеющих, как правило, рН в диапазоне 5,5–8,8).
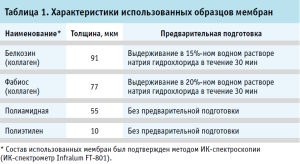
Характеристики использованных образцов мембран приведены в таблице 1.
Микроструктура мембран была исследована с использованием электронного микроскопа Phenom ProХ (см. рис. 2–5).



Поскольку величина плотности потока обычно не представляет большого практического интереса, и более информативным является изменение концентрации во времени, в качестве практической величины нами была изучена зависимость изменения концентрации диклофенака от времени его диффузии через исследуемые мембраны. Были использованы следующие образцы, реактивы и оборудование: раствор диклофенака (концентрация 0,5 мг/мл) объемом по 5 мл в каждой пробе; принимающая среда – смесь 0,1М раствора хлористоводородной кислоты (30%) и этанола (70%) объемом 75 мл. Скорость вращения мешалки 200 об/мин. Температура 20–22°С, аналитический метод – спектрофотометрический (Спектрофотометр Shimadzu модели UV-1800, длина волны – 276 нм). При наличии предварительной подготовки мембран ее характер указан в таблице 1.
Результаты исследования диффузионной способности образцов мембран оценивались без количественного учета их толщины (по принципу «как есть»).
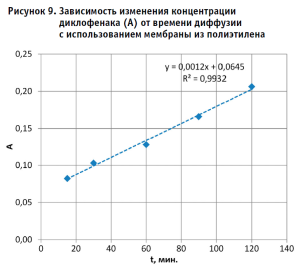
Выявленные зависимости изменения концентрации диклофенака в принимающей среде (в качестве опосредованной величины, соответствующей концентрации диклофенака, использовали оптическую плотность (А)) от времени диффузии через исследуемые мембраны в описанных выше условиях эксперимента приведены на рисунках 6–9. Из результатов исследования, приведенных в графической форме на рисунках 6–9, можно сделать следующие выводы:
- Диффузионные процессы с использованием всех испытанных образцов мембран характеризуются приемлемой линейностью в испытанном временном диапазоне (коэффициент корреляции имеет значения от 0,9895 – для полиамидной мембраны до 0,9957 – для коллагеновой мембраны «Белкозин»).
- Испытанные образцы коллагеновых и амидной мембран (несмотря на относительно большую их толщину (см. табл. 1) обеспечивают сравнительно высокую диффузионную способность по отношению к диклофенаку (А имеет значения от 0,32 – для коллагеновой мембраны «Фабиос», до 0,62 – для полиамидной мембраны). При этом достаточно тонкая (10 мкм) полиэтиленовая мембрана характеризуется сравнительно низкой диффузионной способностью (А = 0,21). Данные различия могут объясняться сравнительно высокой афинностью диклофенка к мембранам, имеющим в составе полярные группы и, соответственно, относительно низкой афинностью диклофенка к гидрофобной полиэтиленовой мембране.
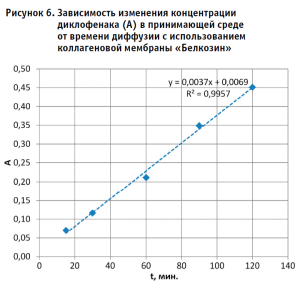
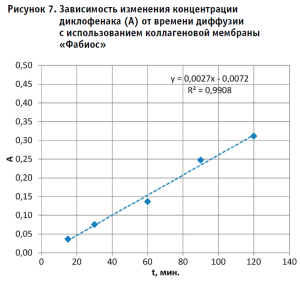
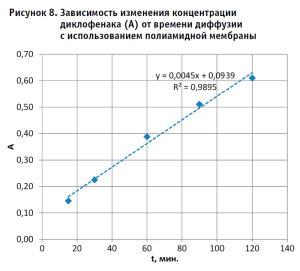
В то же время, обращает на себя внимание различие диффузионной способности образцов двух коллагеновых мембран разных производителей («Белкозин» и «Фабиос»).
- Полученные экспериментальные данные и теоретические положения могут свидетельствовать о том, что наиболее перспективными для дальнейшего изучения скорости диффузии диклофенака из мягких лекарственных форм в соответствии с предлагаемой методикой IVRT являются коллагеновые и полиамидные мембраны (в описанных выше условиях эксперимента). Для оценки перспективности полиэтиленовой мембраны необходимо проведение дополнительного исследования в условиях, отличных от использованных в данной работе и описанных выше.
Очевидно, что представленные нами результаты являются лишь определенным вкладом в накопление фактического материала по исследованию единичных и комплексных факторов, влияющих на способности различных мембран к диффузии актуального многообразия ДВ. Данные работы в настоящее время находятся на первоначальном этапе и, к сожалению, не носят системного характера.
Выводы
- Установление характеристического профиля проникновения лекарственного препарата с использованием дискриминативного (функциональным синонимом является информативность) испытания на проникновение in vitro (IVPT) представляет собой важный аспект контроля качества и эффективности лекарственных средств. Это испытание помогает оценить, как изменения в технологической формуле препарата влияют на его способность проникать через кожный барьер на протяжении всего жизненного цикла. Важно отметить, что такие исследования не только необходимы для контроля качества, но и служат основой для обоснования эквивалентности нового препарата по сравнению с уже зарегистрированными.
Таким образом, исследования IVPT не только помогают обеспечить соответствие нормативным требованиям, но и играют ключевую роль в создании эффективных и безопасных лекарственных форм, что в дальнейшем может существенно влиять на разработку и коммерциализацию лекарственных средств.
- В результате проведенного экспериментального исследования установлено:
2.1. Диффузионные процессы с использованием всех испытанных образцов мембран характеризуются приемлемой линейностью в испытанном временном диапазоне.
2.2. Испытанные образцы коллагеновых и амидной мембран обеспечивают сравнительно высокую диффузионную способность (скорость диффузии) по отношению к диклофенаку. Исследованный образец полиэтиленовой мембраны характеризуется сравнительно низкой диффузионной способностью. Указанные различия могут объясняться сравнительно высокой афинностью диклофенка к мембранам, имеющим в составе полярные группы и, соответственно, относительно низкой афинностью диклофенка к гидрофобной полиэтиленовой мембране.
Диффузионная способность образцов однотипных по химическому составу (коллагеновых) мембран разных производителей («Белкозин» и «Фабиос») различна.
2.3. Наиболее перспективными для дальнейшего изучения скорости диффузии диклофенака из мягких лекарственных форм в соответствии с предлагаемой методикой IVRT являются коллагеновые и полиамидные мембраны. Для комплексной оценки перспективности полиэтиленовой мембраны необходимо проведение дополнительных исследований в иных условиях.
- Решение Совета Евразийской экономической комиссии от 03.11.2016 № 85 (ред. от 12.04.2024) «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза. Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза». Приложение № 13. Требования к качеству и биоэквивалентности лекарственных препаратов для местного применения при нанесении на кожу и иными способами локального применения. Приложение № 1. Методика исследования на высвобождение in vitro (IVRT).
- Решение Коллегии Евразийской экономической комиссии от 17.07.2018 № 113 «Об утверждении Руководства по валидации аналитических методик проведения испытаний лекарственных средств».
- Сушинская О.А., Голяк Н.С., Царенков В.М. Методы исследования высвобождения лекарственных веществ из наружных лекарственных форм // Вестник фармации. – 2019. – №4. – С. 86–96.
- Sintov A.C. Transdermal drug delivery using microemulsion and aqueous systems: Influence of skin storage conditions on the in vitro permeability of diclofenac from aqueous vehicle systems / A.C. Sintov, S. Botner // International Journal of Pharmaceutics. – 2006. – Vol. 311, № 1–2. – P. 55–62.
- Лобанов М.Л. Методы определения коэффициентов диффузии: учебное пособие / М.Л. Лобанов, М.А. Зоринов. – Екатеринбург: Изд-во Урал. ун-та, 2017, С. 6.
