КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Генетические маркеры риска тяжелого течения COVID-19 у этнических групп Российской Федерации и смертность от COVID-19 – есть ли связь?
1 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0000-0001-9001-1499
2 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0000-0003-3278-5941
3 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0000-0003-4006-6787
4 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0009-0001-2744-2752
5 — Российско-японский медицинский центр «Саико», 680000, Российская Федерация, г. Хабаровск, ул. Комсомольская, д. 104.
ORCID: https://orcid.org/0000-0002-3176-2716
6 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.; Федеральное государственное бюджетное образовательное учреждение высшего образования «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева», 430005, Российская Федерация, г. Саранск, ул. Большевистская, д. 68.
ORCID: https://orcid.org/0000-0003-0227-2651
7 — Государственное бюджетное учреждение Республики Марий Эл «Козьмодемьянская межрайонная больница» 425350, Российская Федерация, г. Козьмодемьянск, 3-й мкр, д. 25.
8 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0000-0001-7903-2977
9 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0000-0002-1242-0833
10 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0000-0002-9307-4994
11 — ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, 125993, Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
ORCID: https://orcid.org/0000-0002-4496-3680
В работе представлены результаты изучения распространенности генетических маркеров (rs11385942 G>GA и rs657152 C>A), ассоциированных с тяжелым течением COVID-19, в различных этнических группах России (мордва, марийцы и нанайцы) и поиск корреляции с эпидемиологическими показателями. Исследование включало 289 здоровых добровольцев: 89 марийцев, 102 мордвы и 98 нанайцев. Генотипирование осуществлялось методом полимеразной цепной реакции в режиме реального времени.
Корреляция между частотой генетических маркеров rs11385942 G>GA и rs657152 C>A в этнических группах мордвы, марийцев и нанайцев с количеством случаев выздоровлений и смертей от COVID-19 в регионах проживания данных народностей с учетом доли их в общей численности населения региона не была установлена. Выявлено, что вариант GA по rs11385942 достоверно реже встречался у нанайцев (2,00%) по сравнению с русскими (8,66%), мордвой (9,30%) марийцами (9,60%).
Полученные результаты подчеркивают необходимость дальнейших исследований для более точного понимания роли генетических факторов в предрасположенности к тяжелому течению COVID-19.
Ключевые слова: COVID-19, генетические особенности, генетические маркеры, ассоциированные с тяжелым течением COVID-19, корреляция генетических маркеров с эпидемиологическими показателями, этнические группы России, тяжелое течение COVID-19
Введение
Пандемия новой коронавирусной инфекции COVID-19 продолжает оказывать значительное влияние на здоровье населения по всему миру. Летальность среди инфицированных пациентов остается высокой, особенно среди лиц с сопутствующими заболеваниями и в группах риска.
Анализ статистических данных международных организаций, собирающих информацию о заболеваемости и смертности от COVID-19, демонстрирует значительную неоднородность этих показателей по странам и регионам. Например, заболеваемость COVID-19 в странах Северной Европы значительно ниже, чем в южных странах (Италия, Испания, Франция). [1].
Исследования последних лет выявили, что генетические факторы могут определять некоторую предрасположенность к тяжелому течению COVID-19 и повышению риска летального исхода. Так, исследование геномных ассоциаций с участием 1610 пациентов с COVID-19 и 2205 субъектов контрольной группы выявило два ключевых геномных участка, ассоциированных с тяжелой дыхательной недостаточностью: было установлено, что носительство минорных аллелей двух полиморфизмов – rs11385942 (замена G>GA) в локусе 3p21.31 и rs657152 (замена C>A) в локусе 9q34.2 – связано с повышенным риском тяжелого течения заболевания [2].
Различия в частоте встречаемости генетических маркеров в различных регионах мира могут частично объяснить вариабельность тяжести пандемии и различия в уровне смертности [3]. В этом контексте определенное значение приобретают данные о распространенности генетических маркеров, определяющих восприимчивость к заболеванию и его тяжелому течению.
В условиях этнического и географического многообразия населения России знание распределения клинически значимых генетических маркеров может стать ключевым инструментом для разработки регионально адаптированных подходов к персонализации фармакотерапии и тактики оказания медицинской помощи в целом.
Материалы и методы
Этический комитет
Исследование выполнено в соответствии с Хельсинкской декларацией и было одобрено Этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России (г. Москва). Перед отбором генетического материала от всех участников получали письменное информированное согласие на русском языке. Согласно условиям информированного согласия, все результаты исследований могут быть использованы в научных целях без раскрытия персональных идентификаторов.
Изучаемая популяция
В исследовании были прогенотипированы образцы 289 здоровых добровольцев из трех этнических групп: 89 марийцев, 102 мордвы и 98 нанайцев.
Этническая принадлежность определялась путем самоидентификации участников и их родителей. Как показано в ранее проведенных исследованиях, отмечается высокая корреляция между использованным методом самоидентификации и определением микросателлитных маркеров этнической принадлежности [4]. В исследование не включали потомков разноэтнических браков.
Распространенность аллельных вариантов rs11385942 G>GA и rs657152 C>A среди изучаемых групп сравнивали между собой и с частотой встречаемости среди русских – этнической группы, наиболее многочисленной в России.
Генотипирование
Материалом для определения генетических полиморфизмов послужили 4 мл крови из вен локтевого сгиба, собранные с помощью вакуумной системы для взятия венозной крови VACUETTE (Greiner Bio-One, Австрия) в пробирки с ЭДТА. Выделение ДНК осуществляли с помощью набора реагентов «ДНК-Экстран-1» (ЗАО «Синтол», Москва, Россия).
Носительство полиморфных маркеров rs11385942 G>GA и rs657152 C>A выявлялось методом полимеразной цепной реакции в режиме реального времени с помощью коммерческих наборов реагентов для определения соответствующих полиморфизмов (ООО «ТестГен», Россия). ПЦРанализ проводился на амплификаторе Real-Time CFX96 Touch (Bio-Rad Laboratories, Inc., США). В соответствии с инструкцией производителя, для каждого полиморфного маркера первая денатурация составляла 2 минуты при температуре 95°C, вторая – 10 секунд при температуре 94°C. Этап отжига для rs11385942 составил 40 секунд при температуре 58°C, для rs657152 – 1 минута при температуре 57°C. Во время отжига производилось измерение сигнала флюоресценции. Последние два этапа повторялись 40 циклов. Сигнал флуоресценции развивался по соответствующему каналу: FAM и VIC
Статистическая обработка
Оценивалось соответствие частот генотипов равновесию Харди–Вайнберга с использованием критерия 2 (Пирсона) (при p>0,05 равновесие выполняется). Для оценки различий частот встречаемости различных аллелей между группами использовали точный тест Фишера.
В качестве средств статистической обработки применялся пакет программ IBM SPSS Statistics 22, GraphPad InStat. Для всех результатов статистически значимым считали значение p<0,05.
Корреляции между частотами изученных SNP и эпидемиологическими параметрами на 100 тыс. населения расcчитывали с помощью коэффициента корреляции Пирсона, рассчитанного в программе StatSoft Statistica.
Цель исследования
Изучить, каким образом однонуклеотидные полиморфизмы rs11385942 G>GA и rs657152 C>A, ассоциированные по некоторым данным с тяжелым течением COVID-19, распределены в этнических группах Поволжья (на примере мордвы и марийцев) и Дальнего Востока (на примере нанайцев) – мультиэтнических регионах России, а также осуществить поиск корреляции частот вариантов риска с эпидемиологическими показателями по COVID-19 в регионе проживания этнической группы.
Результаты
По обоим аллельным варианта rs11385942 G>GA и rs657152 A>C распределение генотипов в изучаемых выборках согласовывалось с распределением Харди – Вайнберга (p>0,05) (таблица 1), что говорило о том, что выборки были сформированы случайным образом для дальнейшего сравнения.
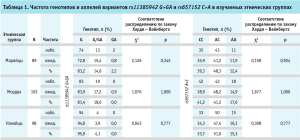
Далее было проведено сравнение частот аллелей rs11385942 G>GA и rs657152 A>C в изучаемых группах попарно между собой и с референсной выборкой русских как наиболее многочисленной этнической группой в России (табл. 2 и 3). Данные по частоте изучаемых аллелей для русской этнической группы были взяты из популяционного исследования, проведенного в России [5].
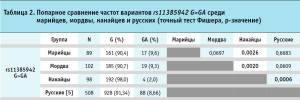

Сравнение частоты распределения rs11385942 G>GA в группах показало, что поволжские группы не отличались между собой: среди марийцев частота составляла 9,6%, среди мордвы – 9,3%. Данные показатели соответствовали распределению rs11385942 G>GA в русской этнической группе (8,66%), статистически значимых отличий не было. Интересной находкой является низкая частота варианта GA у нанайцев (2,0%), статистически значимо реже встречающегося при сравнении с русскими, мордвой и марийцами.
Распределение варианта rs657152 A>C среди изученных этнических групп было более равномерным и составляло: 36,5% среди марийцев, 38,2% среди мордвы и 40,8 у нанайцев. При сравнении с частотой rs657152 A>C среди русских (59,52%) статистически значимых различий выявлено не было.
Частоты распределения обоих маркеров в изученных этнических группах были проанализированы в контексте показателей выздоровления от COVID-19 и смертности в регионах, где собирался генетический материал популяционного исследования. Информация о количестве случаев заболевания COVID-19, выздоровления, смертности и численности населения соответствующих регионов представлена в таблице 4.
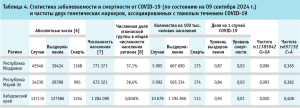
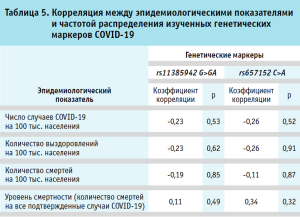
Слабые отрицательные корреляции были установлены между частотами обоих аллелей риска и числом случаев COVID-19, нормированным на 100 тыс. населения. В отличие от этого, корреляции между обеими аллелями риска и уровнем смертности, рассчитанным как количество смертей на общее число случаев COVID-19, были положительными. Корреляция между смертностью от COVID-19 и частотой обоих маркеров rs11385942 G>GA (r = 0,11; p=0,49) и rs657152 C>A (r = 0,34; p=0,32) была незначимой (таблица 5).
Обсуждение
Исследование генетических особенностей пациентов с тяжелым течением COVID-19, проведенное Ellinghaus D. и соавторами (2020) в самом начале пандемии на выборке пациентов из клиник Италии и Испании, описывает область на хромосоме 3p21.31, включающей гены SLC6A20, LZTFL1, CCR9, FYCO1, CXCR6 и XCR1. Исследование выявило сильную ассоциацию носительства варианта rs11385949 G>GA с более высокой вероятностью развития тяжелых осложнений, таких как острая дыхательная недостаточность (ОШ 1,77; 95% ДИ 1,48 2,11; P= 1,15 × 10-10) [2]. Возможное объяснение данного результата исследования заключается в том, что область рядом с rs11385942 на хромосоме 3p21.31 значительно влияет на экспрессию гена LZTFL1 (р<0.05), который регулирует функцию ресничек эпителия дыхательных путей [9].
Еще одним важным результатом анализа Ellinghaus D. и соавт. стало выявление ассоциативного сигнала полиморфизма rs657152 A>C в области 9q34.2, который совпадает с геном, ответственным за группы крови системы AB0. Носительство варианта rs657152 A>C ассоциировалось с более высокой частотой развития дыхательной недостаточности (ОШ 1,32; 95% ДИ 1,20 – 1,47; P = 4,95 10-8) [2]. Исследование Steffen B.T. и соавт. (2022) также отметило связь варианта rs657152 A>C и группы крови AB0 с уровнем VWF, как вероятного фактора риска госпитализации по поводу респираторных инфекций [11].
Кроме того, исследователи установили связь между наличием варианта rs11385949 G>GA и группой крови AB0 с активацией комплемента у больных COVID-19. В группе из 72 пациентов европейского происхождения было показано, что вариант rs11385949 G>GA ассоциировался с повышенной активацией как C5a, так и конечного комплекса комплемента SC5b-9, тогда как у пациентов с не-0(I) группой крови наблюдалась лишь повышенная активация C5a [12]. Эти данные подтверждают значимость системы комплемента в повреждении легких.
Связь маркера rs657152 C>A с уровнем вирусной нагрузки и вероятностью заболевания была изучена в работе Орловой Е.А. и соавторов (2021), но связь с тяжестью течения COVID-19 не была выявлена. Анализ частот rs657152 C>A у 129 больных COVID-19 и 466 здоровых лиц не показал значимых различий между этими группами, как и различий в распределении между пациентами с высокой и низкой вирусной нагрузкой, что говорит о том, что носительство rs657152 C>A само по себе не является фактором риска тяжелого течения COVID-19 [13]. Схожие данные были получены и в исследовании Marсalo R. и соавт. (2022), в котором оценивался вклад рассматриваемых маркеров в тяжесть заболевания и выживаемость при COVID-19 в группах пациентов с ХОБЛ (n = 255) и в группе здорового контроля (n = 243) – никаких различий выявлено не было (все p-значения > 0,01), как при рассмотрении аллелей риска по отдельности, так и комбинаций аллелей или при полигенной оценке риска [14].
В разных популяциях частота изученных аллельных вариантов варьирует. Так, для Европы частота в Португалии, Испании и Италии составляет 5,82%, 6% и 10,33% для rs11385942 G>GA, и 57,86%, 62,59% и 61,57% для rs657152 C>A соответственно [14]. В работе Balanovsky O. и соавт. (2021) было установлено, что частоты rs11385942 G>GA плавно уменьшаются по мере перехода с запада на восток Евразии. Для rs657152 A>C подобное распределение было более равномерным [15].
Исследование Balanovsky O. и соавт. (2021) показало положительную корреляцию между частотой носительства маркеров rs11385942 G>GA и rs657152 C>A и смертностью от COVID-19 в популяциях России, при этом особенно сильная корреляция была отмечена для rs657152 A>C (r = 0,59, p = 0,02). Авторы подчеркивали, что такая корреляция имеет значение только для российской выборки и не наблюдается в мировых популяциях [15].
Нами предпринята попытка поиска связи между частотой генетических маркеров в этнических группах мордвы, марийцев и нанайцев и заболеваемостью, а также исходами COVID-19 в регионах проживания данных народностей с учетом доли их в общей численности населения региона. Для анализа распространенности генетических маркеров использовались образцы из биоресурсной коллекции НИИ молекулярной и персонализированной медицины РМАНПО. Нами были получены отрицательные результаты в отношении корреляции частот генетических маркеров и эпидемиологическими показателями по COVID-19, таким образом, результаты нашего исследования не соотносятся с данными Balanovsky O. и соавторов. Вероятно, это может быть связано с небольшим объемом выборки, а также с тем, что анализ проводился с суррогатными эпидемиологическими показателями, не содержащими точной численности заболевших, выздоровевших и умерших от новой коронавирусной инфекции представителей конкретных народностей. Таким образом, наши данные можно считать предварительными, а проблему поиска генетических маркеров риска тяжелого течения COVID-19 – требующей дальнейшего изучения.
Также мы обнаружили достоверные различия в частоте встречаемости варианта GA по rs11385942 – данный генетический маркер встречался достоверно реже у нанайцев (2,00%) по сравнению с русскими (8,66%), мордвой (9,30%) марийцами (9,60%). Эти данные подтверждают общую тенденцию к более низкой частоте указанного варианта в азиатской популяции и соответствуют частоте у нанайцев по результатам Balanovsky O. и соавт. Необходимо подчеркнуть, что изучение распределения генетических маркеров восприимчивости к заболеваниям, таким как COVID-19, имеет несколько важных аспектов, которые могут значительно повысить эффективность медицинского вмешательства и стратегий общественного здравоохранения. Понимание того, как генетические маркеры распределяются среди различных этнических субпопуляций в рамках одного государства, помогает разработать регион-специфические меры борьбы и профилактики заболеваний. В зависимости от частоты определенных генетических маркеров в различных регионах страны можно создавать более точные рекомендации для системы здравоохранения, адаптировать протоколы лечения и профилактики. Данные меры могут включать как локальные мероприятия карантина и использования медицинских ресурсов, так и планирование потребностей в лекарственных препаратах, вакцинах и медицинском оборудовании.
Знание этнических особенностей распределения маркеров восприимчивости важно для прогнозирования и управления вспышками заболеваний. Понимание того, какие суб-популяции более подвержены тяжелому течению болезни, позволяет лучше предсказывать развитие эпидемий, их интенсивность и потенциальные риски для различных групп населения. Это дает возможность более оперативно и эффективно реагировать на новые волны заболеваний, снижать нагрузку на систему здравоохранения и минимизировать количество тяжелых случаев и смертей.
Заключение
Нами не было обнаружено корреляции между частотой генетических маркеров rs11385942 G>GA и rs657152 C>A в этнических группах мордвы, марийцев и нанайцев, с заболеваемостью, а также исходами COVID-19 в регионах проживания данных народностей с учетом доли их в общей численности населения региона. Было установлено, что вариант GA по rs11385942 достоверно реже встречался у нанайцев (2,00%), по сравнению с русскими (8,66%), мордвой (9,30%), марийцами (9,60%).
Изучение вопроса распределения генетических маркеров восприимчивости к заболеваниям, таким как COVID-19, является одним из важнейших элементов для повышения качества медицинской помощи, разработки эффективных и персонализированных мер профилактики и лечения, а также обеспечения более надежного контроля за эпидемиями в будущем
- Европейский центр по профилактике и контролю заболеваний: [сайт]. – URL: https://www.ecdc.europa.eu/en/covid-19-pandemic (дата обращения 09.09.2024 г.).
- Severe Covid-19 GWAS Group; Ellinghaus D., Degenhardt F., et al. Genomewide Association Study of Severe Covid-19 with Respiratory Failure. N Engl J Med. 2020 Jun 17; 383(16). DOI: 10.1056/NEJMoa2020283.
- Ji X.S., Chen B., Ze B., Zhou W.H. Human genetic basis of severe or critical illness in COVID-19. Front Cell Infect Microbiol. 2022 Sep 20; 12. DOI:10.3389/fcimb.2022.963239.
- Tang H., Quertermous T., Rodriguez B., et al. Genetic structure, self-identified race/ethnicity, and confounding in case-control association studies. Am J Hum Genet. 2005 Dec 29; 76(2). DOI:10.1086/427888.
- Balanovsky O., Petrushenko V., Mirzaev K., et al. Variation of Genomic Sites Associated with Severe Covid-19 Across Populations: Global and National Patterns. Pharmgenomics Pers Med. 2021 Nov 4; 14. DOI: 10.2147/PGPM.S320609.
- Статистика распространения коронавируса в России: [сайт]. – URL: https://coronavirus-monitor.info/country/russia/ (дата обращения 12.09.2024 г.).
- Statdata.ru: [сайт]. – URL: http://www.statdata.ru/largest_regions_russia (дата обращения 12.09.2024 г.).
- Итоги ВПН-2020. Том 5 Национальный состав и владение языками: [сайт]. – URL: https://rosstat.gov.ru/vpn/2020/Tom5_Nacionalnyj_sostav_i_vladenie_yazykami (дата обращения 12.09.2024 г.).
- Fink-Baldauf I.M., Stuart W.D., Brewington J.J., et al. CRISPRi links COVID-19 GWAS loci to LZTFL1 and RAVER1. EBioMedicine. 2022 Jan 6; 75. DOI: 10.1016/j.ebiom.2021.103806.
- Zietz M., Zucker J., Tatonetti N.P. Associations between blood type and COVID-19 infection, intubation, and death. Nat Commun. 2020 Nov 13; 11(1). DOI: 10.1038/s41467-020-19623-x.
- Steffen B.T., Pankow J.S., Lutsey P.L., et al. Proteomic profiling identifies novel proteins for genetic risk of severe COVID-19: the Atherosclerosis Risk in Communities Study. Hum Mol Genet. 2022 Jul 21; 31(14). DOI: 10.1093/hmg/ddac024.
- Valenti L., Griffini S., Lamorte G., et al. Chromosome 3 cluster rs11385942 variant links complement activation with severe COVID-19. J Autoimmun. 2021 Jan 9; 117. DOI: 10.1016/j.jaut.2021.102595.
- Орлова Е.А. Вариант rs657152 не ассоциируется с уровнем вирусной нагрузки при COVID-19 или вероятностью заболевания в популяции европеоидов Восточной Сибири / Е.А. Орлова, О.Б. Огарков, П.А. Хромова Синьков В.В., Хаснатинов М.А., Жданова С.Н., Рычкова Л.В., Колесникова Л.И. // Генетика. – 2021. – Т. 57. – № 8. – С.974–976 DOI: 10.31857/S0016675821080099.
- Marсalo R., Neto S., Pinheiro M., et al. Evaluation of the genetic risk for COVID-19 outcomes in COPD and differences among worldwide populations. PLoS One. 2022 Feb 23; 17(2). DOI: 10.1371/journal.pone.0264009.
- Balanovsky O., Petrushenko V., Mirzaev K., et al. Variation of Genomic Sites Associated with Severe Covid-19 Across Populations: Global and National Patterns. Pharmgenomics Pers Med. 2021 Nov 4; 14. DOI: 10.2147/PGPM.S320609.
