ЭКОНОМИЧЕСКАЯ ЭФФЕКТИВНОСТЬ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ
Клинико-экономическая эффективность методики транскатетерной имплантации аортального клапана у пациентов тяжелым аортальным стенозом и средним и низким хирургическим риском
1 — ФБОУ ВО «Российская академия народного хозяйства и государственной службы при Президенте Российской Федерации», 119571, Российская Федерация, г. Москва, просп. Вернадского, д. 82.
ORCID: https://orcid.org/0000-0002-4781-2773
2 — ФБОУ ВО «Российская академия народного хозяйства и государственной службы при Президенте Российской Федерации», 119571, Российская Федерация, г. Москва, просп. Вернадского, д. 82.; ФГБОУ ДПО РМАНПО Минздрава России, 125993 Российская Федерация, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.; ФГБУ «Всероссийский научно-исследовательский и испытательный институт медицинской техники» Росздравнадзора, 115478, Российская Федерация, г. Москва, Каширское шоссе, д. 24, стр. 16.
ORCID: https://orcid.org/0000-0003-3481-6190
3 — ФГАОУ ВО «Национальный исследовательский университет ИТМО», 197101, Российская Федерация, г. Санкт-Петербург, Кронверкский проспект, д. 49, лит. А.
ORCID: https://orcid.org/0009-0002-6082-5680
4 — Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр кардиологии имени академика Е.И. Чазова» Министерства здравоохранения Российской Федерации, 121552, Российская Федерация, г. Москва, ул. Академика Чазова, д. 15а.
ORCID: https://orcid.org/0000-0001-8193-8575
В статье представлен анализ литературы, посвященной анализу клинико-экономической эффективности методики транскатетерной имплантации аортального клапана у пациентов тяжелым аортальным стенозом и средним и низким хирургическим риском.
Ключевые слова: клинико-экономическая эффективность, клинико-экономический анализ, оценка медицинских технологий, моделирование, модель Маркова, древо решений, аортальный стеноз, эндоваскулярная хирургия, замена аортального клапана, транскатетерная имплантация аортального клапана (ТИАК), хирургическая имплантация аортального клапана (ХИАК)
Введение
Под аортальным стенозом (далее – АС) понимается сужение аортального клапана, затрудняющего отток крови из левого желудочка в аорту [1]. Точные эпидемиологические данные о распространенности АС в Российской Федерации в настоящее время отсутствуют. В Европе и США было проведено четыре эпидемиологических исследования по распространенности АС. По результатам 11 911 эхокардиографических исследований АС был диагностирован у 0,4% пациентов. Распространенность АС увеличивается с возрастом и, если до 65 лет она составляет 0,2%, то у пациентов от 65 до 74 лет – 1,3% и 2,8% в возрасте старше 75 лет [1]. Учитывая отсутствие стратегии, направленной на предотвращение AС или замедление его прогрессирования, распространенность АС в ближайшее время не уменьшится. Более того, в ближайшие десятилетия из-за старения населения ожидается значительное увеличение числа пациентов с АС.
У пациентов с симптоматическим тяжелым аортальным стенозом, которым не было выполнено протезирование аортального клапана, наблюдается высокая смертность [1]. Около 44% пациентов с симптоматическим критическим аортальным стенозом умерли в течение 14,5 месяцев [2]. Транскатетерная имплантация аортального клапана (далее – ТИАК) – это минимально инвазивная процедура, в ходе которой осуществляется замена стенозированного клапана на биопротез. Она часто рассматривается как альтернатива традиционной хирургической имплантации аортального клапана (далее – ХИАК) у пациентов с высоким хирургическим риском [1, 2]. У пациентов с промежуточным хирургическим риском клиническая эффективность ТИАК была сопоставима с ХИАК в рандомизированных контролируемых исследованиях [2]. В отличие от опубликованных данных по пациентам с критическим аортальным стенозом, которые были признаны неоперабельными или имели неприемлемо высокий хирургический риск, неоднозначные результаты наблюдались в группе промежуточного хирургического риска.
С точки зрения системы здравоохранения необходимо учитывать клинические и экономические данные при принятии решений о финансировании [3]. Анализы, представленные на сегодняшний день, в основном основаны на результатах двухлетних исследований, а экстраполяции их для долгосрочных результатов могут оказать существенное влияние на оценки экономической эффективности [4].
Целью настоящей статьи является оценка работы по моделированию экономической эффективности ТИАК по сравнению с ХИАК у пациентов с высоким и промежуточным риском, а также возможность применения этих моделей для российской системы здравоохранения.
Структура моделей и основные характеристики
Для оценки экономической эффективности ТИАК по сравнению с ХИАК в работе R. See-Toh и соавт. была разработана трехстадийная марковская модель экономической эффективности у пациентов с тяжелым АС с промежуточным хирургическим риском [5].
Клинические исходные данные были получены из рандомизированного исследования PARTNER 2A [6], где в качестве вмешательства для лечения пациентов рассматривалось ТИАК (баллонно-расширяемая система клапанов SAPIEN XT, Edwards Lifesciences), а в качестве технологии сравнения – ХИАК [7].
Средний возраст участников исследования составил 81 год, 54% были мужчинами, средний показатель прогнозируемого риска смертности составил 5,8% (оценка в диапазоне от 4 до 8% считается промежуточным риском). Около 77% пациентов имели III или IV класс по шкале Нью-Йоркской ассоциации сердца (NYHA) и от 66 до 69% имели ишемическую болезнь сердца. В модели предполагалось, что пациенты входят в модель в возрасте 80 лет [5].
Имитационная модель включала в себя три состояния здоровья: «инсульт», который представлял собой инвалидизирующий или тяжелый инсульт, серьезное осложнение с долгосрочными последствиями; «отсутствие инсульта» и «смерть» – (рис. 1).
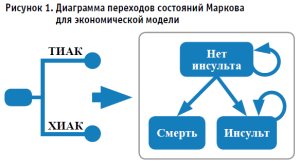
Длина месячного цикла была выбрана таким образом, чтобы отразить соответствующие изменения в состоянии здоровья. В течение первого месяца после процедуры пациенты, оставшиеся в живых, переходили в состояние «инсульт», если они перенесли инвалидизирующий или инсульт тяжелой степени, или переходили в состояние «без инсульта». При этом пациенты могли либо оставаться в нем, либо переходить в состояние «смерть» в случае летального исхода. Пациенты без инсульта оставались в состоянии «без инсульта», если только у них не произошел эпизод инсульта тяжелой степени или они не умерли. Все моделируемые пациенты также подвергались риску развития других клинически значимых осложнений – инфаркта миокарда, крупных сердечно-сосудистых осложнений, угрожающих жизни, крупных кровотечений, эндокардита, имплантации постоянного кардиостимулятора, транзиторной ишемической атаки, острого повреждения почек, фибрилляции предсердий (далее – ФП), а также повторной госпитализации после процедуры. Осложнения приводили к увеличениям затрат во время цикла моделирования. В базовом варианте использовался пятилетний временной горизонт для определения затрат и эффективности, что соответствовало наиболее длительному наблюдению в рамках исследования PARTNER 2A. Будущие затраты и эффективность дисконтировались по ставке 3% в год [5]. В анализ включались только прямые медицинские расходы. Моделирование методом Монте-Карло с 10 000 итераций (начальное число равно 1).
Для проверки устойчивости результатов модели к данным и методологическим допущениям было проведено четыре сценарных анализа:
Сценарий 1. Клинические исходы при использовании клапана SAPIEN 3 (исследование PARTNER S3i PSM);
Сценарий 2. Клинические исходы при использовании системы CoreValve®(SM) (исследование SURTAVI);
Сценарий 3. Горизонт жизни 20 лет, применяемый в базовом варианте;
Сценарий 4. Включение потерь, связанных с осложнениями в базовом варианте.
M. Gilard и соавт. изучали как прямые затраты на здравоохранение, так и качество жизни, связанное со здоровьем (HRQOL) при использовании ТИАК по сравнению с ХИАК у людей с аортальным стенозом и низким хирургическим риском (риск хирургической смертности < 4%) [8]. Авторы использовали модель, основанную на осложнениях. В основу данных легло исследование PARTNER 3 [9]. Временной горизонт в 30 лет был выбран для того, чтобы отразить все потенциальные последствия для людей с аортальным стенозом в течение всей жизни.
Модель состояла из двух этапов. На первом этапе учитывались ранние осложнения, связанные с процедурой ТИАК. Данные были получены из результатов исследования PARTNER 3 о 30-дневной летальности (рис. 2).
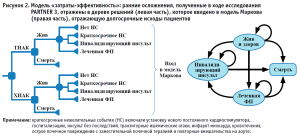
Эти данные были введены в последующую марковскую модель, отражающую более долгосрочные исходы пациентов.
Модель построена с учетом четырех различных состояний здоровья:
- «Жив и здоров»: пациенты перенесли процедуру и выжили с кратковременными нежелательными событиями. Пациенты в этом состоянии здоровья могут перейти в инвалидизирующий инсульт, пролеченную ФП или смерть в любой момент на временном горизонте модели.
- «Леченая ФП»: пациенты перенесли процедуру и выжили, но теперь у них есть ФП и потребовалось специальное лечение. Это может произойти как в течение первых 30 дней, так и в течение всего остального временного горизонта модели. Пациенты в таком состоянии здоровья могут перейти в инвалидизирующий инсульт или умереть в любой момент в течение временного горизонта модели.
- «Инсульт с потерей трудоспособности»: пациенты перенесли процедуру и выжили, но получили инсульт с потерей трудоспособности. Это может произойти в течение первых 30 дней либо в течение оставшегося временного горизонта модели. Пациенты, находящиеся в таком состоянии здоровья, могут перейти в состояние смерти в любой момент на временном горизонте модели.
- «Смерть»: это состояние является поглощающим в модели. Все пациенты в модели подвержены риску смерти из-за общей смертности от всех причин. Пациенты с леченной ФП и инсультом имеют повышенный риск смерти.
В модели «затраты-эффективность» использовались месячные циклы с поправкой на полуцикл, когда это было необходимо для оценки затрат и количества лет жизни с поправкой на качество (QALY). Единственными затратами, которые не корректировались по полуциклу, были затраты на вмешательство, поскольку они возникали в точке входа в модель. Все пациенты понесут эти расходы при условии, что они не умрут во время процедуры, что маловероятно, учитывая низкий риск. Дисконтирование будущих затрат и выгод осуществлялось по ставке 2,5% в соответствии с французскими рекомендациями.
Результаты
Усредненный показатель соотношения затрат и эффективности – ICER значительно снизился – до 86 337 долларов США за QALY в сценарии 1, где клинические результаты для клапана SAPIEN 3 в исследовании PARTNER S3i были значительно ниже и составили 86 337 долларов США благодаря меньшим инкрементным затратам и большему количеству полученных QALY. В сценарии 2, когда клинические результаты основывались на результатах исследования SURTAVI, в котором использовалась система ТИАК CoreValve® System, был получен значительно более высокий показатель ICER в размере 837 595 долларов США за полученный QALY, так как прирост QALY составил всего 0,04. При увеличении временного горизонта с 5 до 20 лет в Сценарии 3, вмешательство ТИАК стало доминировать над ХИАК, поскольку QALY, связанные с ХИАК, были выше, чем с ТИАК, и составило 0,31. Когда были учтены потери, связанные с нежелательными событиями, ТИАК стала немного более благоприятна при снижении ICER на 5%, на уровне 300 070 долларов США на один полученный QALY. В совокупности эти сценарные анализы показали, что ICER очень чувствителен как к источнику данных об эффективности, так и к временному горизонту. И это ключевой аргумент в пользу того, что любое исследование, опубликованное в литературе в пользу одной или другой методики, необходимо дополнять клиническими и экономическими внутренними данными для подтверждения или опровержения исходных клинических данных.
В работе M. Gilard и соавт. Приведена разница в стоимости ТИАК и ХИАК – 12 742 евро. Разница в QALY – 0,89. Выводится утверждение о ТИАК как о доминирующей технологии [8].
Обсуждение
В работе See-Toh R.SE. и соавт. при базовом варианте инкрементный показатель затраты-эффективность (ICER) за один год жизни с поправкой на качество (QALY) был 315 760 долларов США. Это говорит о том, что использование ТИАК у пациентов с промежуточным хирургическим риском не будет считаться экономически эффективным по критериям Всемирной организации здравоохранения (ВОЗ) [5].
Высокий показатель ICER был обусловлен высокими затратами на имплантацию и процедуру ТИАК по сравнению с ХИАК, а также предельным кумулятивным улучшением на 0,10 QALY, так как смоделированная смертность при ТИАК превышала таковую при ХИАК примерно на 45 месяцев (3,75 года) после имплантации. Односторонний анализ чувствительности показал, что ICER оставались высокими, изменяясь от 248 605 до 432 600 долларов США за полученный QALY. Авторы пишут, что в Сингапуре не существует известного порогового значения ICER для медицинских технологий, однако ранее для субсидирования ICER для медицинских технологий были ниже 34 091 долларов США за полученный QALY [10].
Сценарный анализ показал значительные изменения в ICER при изменении источника данных клинических исследований или временного горизонта. Данные об исходах за один год в псевдорандомизированных данных из исследования PARTNER S3i были использованы в Сценарии 1 исследования вместо данных по пятилетним исходам, так как кривые Каплана-Майера по смертности от всех причин и инсульта отсутствовали в последнем случае [11]. Тем не менее, ICER вероятно, будет выше, чем при оценке данных за один год. Это можно предположить, исходя из более высокой смертности от всех причин при ТИАК в течение пяти лет (39,1% по сравнению с 26,8% при ХИАК), а также относительно схожих показателей смертности от всех причин в течение пяти лет для ХИАК (40,8% и 41,3% соответственно). Однако, псевдорандомизированные данные из исследования PARTNER показали, что ранняя смертность от всех причин в течение одного года (ТИАК 6,5% по сравнению с ХИАК 12,2%) уменьшалась через пять лет (ТИАК 39,1% по сравнению с ХИАК 40,8%), показывая, как моделируемые данные могут отличаться от реальных. Это связано с тем, что ранние преимущества не сохранились в представленных результатах исследования. Трудно определить, может ли на это расхождение также повлиять отсутствие рандомизации в PARTNER S3i [11]. Аналогично для системы CoreValve в исследовании SURTAVI [12].
Норвежский институт общественного здравоохранения (NIPH) получил ICER в пользу ТИАК, который варьировался в диапазоне от 119 097 до 134 775 долларов США [13]. Все они использовали данные двухлетнего наблюдения из PARTNER 2A, что привело бы к переоценке преимуществ ТИАК, ведь предполагалось, что ранняя смертность от всех причин сохраняется в экстраполированной траектории на моделируемом временном горизонте от двух лет до пожизненного срока. При применении на более длительном временном горизонте от 15 лет до пожизненного срока, ICER будут еще более благоприятными для ТИАК, хотя и с большей неопределенностью из-за отсутствия надежных клинических данных. Основная проблема, с которой сталкиваются агентства и министерства здравоохранения по оценке медицинских технологий, заключается в том, что доказательная база продолжает развиваться по другой траектории или в другом направлении после принятия решения о возмещении расходов. Поэтому встает закономерный вопрос о том, как часто следует проводить повторную оценку при появлении новых долгосрочных результатов.
Хотя исследования PARTNER 2A и SURTAVI предоставили наиболее надежные пяти- и двухлетние сравнительные данные, в них в основном использовались модели ТИАК более раннего поколения, которые уже не используются в современной клинической практике. А постоянное развитие медицинских технологий способствует снижению количества как периоперационных, так и отдаленных осложнений.
Заключение
Специфическим ограничением исследования клинико-экономической эффективности ТИАК перед ХИАК является то, что варианты анатомии с высоким риском окклюзии коронарных артерий и двустворчатые аортальные клапаны были исключены из большинства исследований, что затрудняет обобщение выводов в целом по методике. Поэтому полученные выводы трудно обобщить на всю популяцию пациентов с аортальным стенозом.
Экономическому моделированию эффективности присущи такие ограничения, как экстраполяция на временные горизонты, которые получаются вне рамок имеющихся исходных данных. Кроме того, результаты нельзя достоверно использовать в рамках систем здравоохранения разных стран, что связано с различными критериями выбора вмешательства.
- Аортальный стеноз. Клинические рекомендации. Год утверждения – 2023. Одобрено на заседании Научно-практического совета Министерства здравоохранения Российской Федерации. Режим доступа: https://labdep.com/storage/editor/Aortalnyiy_stenoz.pdf.
- American Heart Association. Aortic Stenosis Overview. 2020. Режим доступа: https://www. heart.org/en/healthtopics/heart-valve-problems-and-disease/heart-valve-problemsand-causes/ problem-aortic-valve-stenosis.
- Омельяновский В.В. Методические рекомендации по использованию математического моделирования в клинико-экономических исследованиях и исследованиях с использованием анализа влияния на бюджет / В.В. Омельяновский, М.В. Авксентьева, Г.Р. Хачатрян и др. – Москва: ФГБУ «ЦЭККМП» Минздрава России, 2019. – 59 с. Режим доступа: https://rosmedex.ru/pub.
- Goodall G., Lamotte M., Ramos M. [et al.] Cost-effectiveness analysis of the SAPIEN 3 TAVI valve compared with surgery in intermediate-risk patients. J Med Econ. 2019; 22(4): 289–96. doi: 10.1080/13696 998.2018.15596 00.
- See-Toh R.SE., Wong X.Y., Mahboobani, K.S.K.H. [et al.] Costeffectiveness of transcatheter aortic valve implantation in patients with severe symptomatic aortic stenosis of intermediate surgical risk in Singapore. BMC Health Serv Res. 2022;22:994. doi: 10.1186/s12913-022-08369-5.
- Makkar R.R, Thourani V.H, Mack M.J. [et al.] Five-Year Outcomes of Transcatheter or Surgical Aortic-Valve Replacement. N Engl J Med. 2020; 382(9): 799–809. doi: 10.1056/NEJMoa1910555.
- Nishimura R.A., Otto C.M., Bonow R.O. [et al.] 2017 AHA/ ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology. American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017; 135(25): e1159–95. doi: 10.1161/CIR.00000 00000000503.
- Gilard M., Eltchaninoff H., Iung B. [et al.] Cost-Effectiveness Analysis of SAPIEN 3 Transcatheter Aortic Valve Implantation Procedure Compared With Surgery in Patients With Severe Aortic Stenosis at Low Risk of Surgical Mortality in France. Value Health. 2022 Apr; 25(4): 605–613. doi: 10.1016/j.jval.2021.10.003.
- Mack M.J., Leon M.B., Thourani V.H. [et al.] PARTNER 3 Investigators. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019 May 2; 380(18): 1695–1705. doi: 10.1056/NEJMoa1814052.
- Cheng L-J., Wong G., Chay W-Y. [et al.] Costeffectiveness of olaparib maintenance therapy when used with and without restriction by BRCA1/2 mutation status for platinum-sensitive relapsed ovarian cancer. Expert Rev Pharmacoecon Outcomes Res. 2021; 21(3): 441–8. doi: 10.1080/14737167.2021.1890587.
- Baron S.J., Thourani V.H., Kodali S. [et al.] Effect of SAPIEN 3 Transcatheter Valve Implantation on Health Status in Patients With Severe Aortic Stenosis at Intermediate Surgical Risk: Results From the PARTNER S3i Trial. JACC Cardiovasc Interv. 2018; 11(12): 1188–98. doi: 10.1016/j.jcin.2018.02.032.
- Reardon M.J., Van Mieghem N.M., Popma J.J. [et al.] Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017; 376(14): 1321–31 doi: 10.1056/NEJMoa1700456.
- Health Technology Wales. Evidence Appraisal Report: Transcatheter Aortic Valve implantation to treat people with severe symptomatic aortic stenosis, ho are at intermediate surgical risk. 2020; (September): 1–75. Access mode: https://www.healthtechnology.wales/wp-content/uploads/2020/07/EAR024-Transcatheter-Aortic-Valve-implantation-1.pdf.
