ЛЕКАРСТВЕННОЕ ОБЕСПЕЧЕНИЕ
Формирование R&D-команды как основа успеха фармацевтической разработки воспроизведенных лекарственных препаратов
1 — Федеральное государственное образовательное учреждение высшего образования «Пермская государственная фармацевтическая академия» Минздрава России, 614990, Российская Федерация, г. Пермь, ул. Полевая, д. 2.
ORCID: orcid.org/0000-0002-3752-7848
2 — Федеральное государственное автономное образовательное учреждение высшего образования «Пермский государственный национальный исследовательский университет», ул. Букирева, 15, г. Пермь, 614990, Российская Федерация.
ORCID: orcid.org/0000-0003-4032-597Х
3 — Федеральное государственное образовательное учреждение высшего образования «Пермская государственная фармацевтическая академия» Минздрава России, 614990, Российская Федерация, г. Пермь, ул. Полевая, д. 2.
ORCID: orcid.org/0000-0002-4958-2078
4 — Федеральное государственное образовательное учреждение высшего образования «Пермская государственная фармацевтическая академия» Минздрава России, 614990, Российская Федерация, г. Пермь, ул. Полевая, д. 2.; Федеральное государственное автономное образовательное учреждение высшего образования «Пермский государственный национальный исследовательский университет», ул. Букирева, 15, г. Пермь, 614990, Российская Федерация.
ORCID: orcid.org/0000-0001-5579-394X
5 — Министерство здравоохранения Пермского края, 614000, Российская Федерация, г. Пермь, ул Ленина, д. 51.
На этапе перехода от национального регулирования обращения лекарственных средств к единому в рамках Евразийского экономического союза гармонизация требований к фармацевтической разработке лекарственных препаратов определяет необходимость разработки современных подходов не только к процессу разработки, но и к процессу формирования команды специалистов, которые могут успешно реализовать принципы улучшенной (непрерывной) фармацевтической разработки, согласно концепции Quality By Design.
В статье предложена математическая модель, позволяющая прогнозировать количественный состав R&D-команды под действием нескольких факторов и при невозможности широкомасштабных экспериментов. Расчетные данные на основе предложенной модели позволяют сделать вывод о том, что процесс современной качественной разработки, согласно требованиям концепции Quality By Design, в конкретно взятой компании-разработчике будет максимально эффективным, когда в разработке одновременно будет находиться количество препаратов, кратное коэффициенту k, отражающему зависимость количества сотрудников от количества лекарственных препаратов, находящихся на этапе фармацевтической разработки одновременно. Аналогично суммарное количество выделенных групп лекарственных препаратов I, II, III ранга сложности и IV,V рангов сложности также должны удовлетворять этому условию.
Предложенная математическая модель количественного подбора специалистов R&D-команды положена в основу подхода по формированию и развитию R&D-команды для фармацевтической разработки воспроизведенных лекарственных препаратов. С позиции системы обеспечения качества и регламентации в части фармацевтической разработки воспроизведенных молекул, анализу и оценке для процесса качественной фармацевтической разработки должны подвергаться такие ключевые факторы улучшений, как формирование профессиональных компетенций персонала R&D; регламентация порядка взаимодействия участников фармацевтической разработки; внедрение научных подходов в организацию процесса фармацевтической разработки и адаптация элементов структуры фармацевтической системы качества компании с учетом критичности действующих процессов; построение системы непрерывного обучения участников R&D-команды для успешной реализации современных концепций фармацевтической разработки (Quality By Design) и др.
Ключевые слова: фармацевтическая разработка, Quality By Design, R&D-команда, оптимизация, S-определенное количество разрабатываемых воспроизведенных лекарственных препаратов
Введение
На сегодняшний день организации-разработчики и производители лекарственных препаратов (ЛП) находятся в условиях перехода от национального регулирования к единому в рамках Евразийского экономического союза (ЕАЭС).
С одной стороны, государством осуществляется активная поддержка отечественных производителей, направленная на развитие лекарственной безопасности населения, формирование института обеспечения качества ЛП, создание и совершенствование условий для разработки эффективных и безопасных ЛП. С другой стороны, в ЕАЭС определены новые правила и требования в сфере обращения лекарственных средств (ЛС), влекущие ужесточение требований в части фармацевтической разработки (ФР) и регистрации ЛС. В соответствии с гармонизированными документами в части ФР определена необходимость применения современного подхода в рамках концепции Quality By Design c целью дальнейшей гарантии качества разработанного ЛП на всех этапах жизненного цикла ЛП до прекращения его реализации на рынке. Данная ситуация определяет необходимость адаптации актуальных методов и инструментов ФР, а также профессиональное развитие персонала, задействованного в процессах жизненного цикла ЛП [1, 2].
Учитывая текущую геополитическую ситуацию, приоритетом политики Российской Федерации для реализации государственных программ в сфере лекарственного обеспечения является формирование научного потенциала фармацевтической промышленности – создание и совершенствование условий для разработки замещающих ЛП на основе потенциала высококвалифицированных специалистов отрасли.
В связи с этим для реализации принципов улучшенной (непрерывной) ФР, согласно концепции Quality By Design, с целью создания эффективных и безопасных ЛП с заданными показателями качества, члены R&D-команды, задействованные в процессе ФР, должны присутствовать в организации-разработчике в достаточном количестве (самостоятельно определенном высшим руководством компании-разработчика воспроизведенных ЛП) и качестве (владеют необходимыми профессиональными специализированными компетенциями), в зависимости от занимаемой должности и зоны ответственности, при этом стремящиеся непрерывно повышать свою квалификацию [3].
Учитывая вышесказанное, возрастает необходимость построения подходов к оптимизации процессов ФР (организационные технологии и методические инструменты) для обеспечения эффективной разработки, реализацию которых может обеспечить только профессиональная компетентная исследовательская R&D-команда[2].
Изучение доступных результатов проводимых научных исследований в сфере организации фармацевтической разработки и производства ЛП на современном этапе развития показало, что экспертами обсуждаются и решаются следующие задачи: возможности применения принципа Quality By Design в процессе фармацевтической разработки [4], подготовка и профессиональное развитие кадров для производства ЛП [5], а также развитие их вовлеченности в деятельность в условиях меняющихся требований [6], проблемы соблюдения правил GMP [7, 8], вопросы документированного сопровождения фармацевтической разработки [9], регуляторные аспекты регистрации ЛП [10, 11, 12, 13] и др. При этом остаются открытыми вопросы о составе команды, обеспечивающей решение задач в части ФР на основе современных концепций и требований.
В этой связи цель проводимого исследования – обоснование подхода к формированию и развитию R&D-команды для ФР воспроизведенных ЛП на основе математической модели формализованного описания ее структуры и процесса функционирования.
Материалы и методы
В работе были использованы доступные публикации и источники литературы, нормативные документы и руководства по фармацевтической разработке лекарственных препаратов, отчеты по фармацевтической разработке, а также информация компании о количестве ранжированных ЛП, поступающих в разработку, перечень базовых участников R&D-команды, задействованных в разработке одного ЛП. Достижение поставленных целей осуществлялось на основе общенаучных методов исследования в рамках логического анализа, методов фильтрации и ранжирования рисков, анализа видов и последствий отказов, анализа и интерпретации полученных данных о фармацевтической разработке, алгоритмического математического моделирования.
Результаты и обсуждение
На первом этапе исследования авторами была построена математическая модель вычисления оптимального количества сотрудников, задействованных в процессах ФР воспроизведенных ЛП.
Основные потенциальные участники R&D-команды были определены исследователями исходя из данных по ранее проведенной систематизации процессов жизненного цикла разрабатываемого ЛП и оценке их критичности на уровне организации-разработчика, а также с учетом требований современной концепции фармацевтической разработки ЛП Quality By Design с помощью применения инструментов и методов анализа и оценки рисков (с использованием модифицированного метода фильтрации и ранжирования рисков, адаптированного под цели ранжирования) (табл. 1) [14].
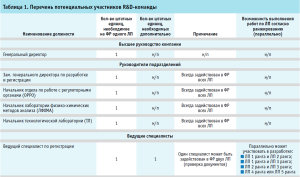
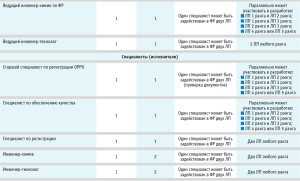
Все возможные участники R&D-команды были разделены на следующие группы (табл. 1):
- высшее руководство компании (CEO – Chief Executive Officer): генеральный директор компании-разработчика ЛП;
- руководители подразделений (HD – heads of department): заместитель генерального директора по ФР и регистрации, начальник отдела по работе с регуляторными органами (ОРРО), начальник лаборатории физико-химических методов анализа (ЛФХМА), начальник технологической лаборатории (ТЛ);
- ведущие специалисты (LEX – leading experts): ведущий специалист по регистрации ОРРО, ведущий инженер-химик по разработке ЛФХМА; ведущий инженер-технолог ТЛ;
- специалисты (исполнители) (SP – specialist performers): старший специалист по регистрации ОРРО, специалист по регистрации ОРРО, инженер-химик ЛФХМА, инженер-технолог ТЛ, специалист по обеспечению качества.
В рамках проведенного исследования были введены следующие функциональные зависимости:
- руководители подразделений – HD (A; B(s, t));
- ведущие специалисты – LEX (F(s, t));
-специалисты (исполнители) – SP (L(s, t); P).
Очевидно, что количество ЛП, находящихся в разработке, влияет на количество работников, задействованных в процессах ФР, и такая связь была представлена функциональной зависимостью от аргумента S (S – количество ЛП). А сложность разработки ЛП влияет на количество работников, и такая связь была представлена функциональной зависимостью от аргумента t (t – ранг сложности разработки ЛП).
Информация о сотрудниках, штатные единицы которых зависят от ранга сложности, представлены в таблице 2.
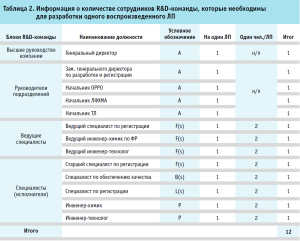
Учитывая функциональные зависимости, представленные в таблице 2, была составлена математическая модель вычисления оптимального количества сотрудников, задействованных в фармацевтической разработке ЛП:
N(s) = HD(A;B(s)) + LEX(F(s)) + SP(L(s);P). (1)
В предложенной математической модели (1) N(s) обозначает оптимальное количество сотрудников. Принимая во внимание все указанные выше зависимости, для полноценной ФР, включая подготовку документов, регистрирующих процессы и материалы регистрационного досье одного ЛП, необходимо 12 сотрудников R&D-команды [15].*
______________________________________________________________
* Окончание статьи будет опубликовано в следующем номере.
