ИННОВАЦИОННЫЕ МЕДИЦИНСКИЕ ТЕХНОЛОГИИ
Разработка инновационной системы универсального стент-графта для эндоваскулярного лечения аневризм различных локализаций
1 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0001-8174-7461
2 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0001-8980-5240
3 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0003-3357-5022
4 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0002-8437-1081
5 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0002-4842-7711
6 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0003-0501-7007
7 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0001-8077-9832
8 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
RCID: https://orcid.org/0000-0003-3882-1720
9 — ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России, 197758, Российская Федерация, г. Санкт-Петербург, п. Песочный, ул. Ленинградская, д. 70.
ORCID: https://orcid.org/0000-0002-1630-0564
В статье представлены результаты разработки универсального стент-графта для эндоваскулярного лечения аневризм различной локализации, без учета анатомических параметров сосуда.
Ключевые слова: аневризма аорты, расслоение аорты, эндопротезирование, эндоваскулярное лечение аневризм, аортальный стент-графт
Введение
Заболеваемость аневризмой абдоминальной аорты составляет от 2% до 8% возрастного населения [1]. Частота встречаемости грудной и торакоабдоминальной аневризм аорты за последнее десятилетие, в том числе за счет улучшения диагностики, значительно возросла и к настоящему времени составляет от 5 до 10 случаев на 100 тыс. населения в год [2]. Летальность от данной патологии в мире составляет 17,7 млн человек [3]. Только в США среди причин смерти аневризмы аорты занимают 13 место [2].
Тактика лечения аневризм аорты непрерывно совершенствуется, что связано с появлением новых способов лечения. Особое развитие данное направление медицины получило с внедрением эндоваскулярных методик [4]. Современный вектор развития методов лечения аневризм аорты направлен в сторону эндографтов [2, 3].
Развитие эндоваскулярных и гибридных методов лечения пациентов с аневризмами грудной и торакоабдоминальной аорты обеспечило технологический прорыв в решении данной проблемы [5]. Тем не менее, накопленный мировой опыт показывает, что эти методы лечения имеют свои фатальные осложнения, требующие не менее сложных решений [6]. Частота серьезных осложнений при эндоваскулярном лечении достигает 25%, а летальность 4–10% [5]. Как правило, это связано с отсутствием в широком доступе фенестрированных эндографтов. Поэтому проблема создания универсального графта с возможностью интраоперационной персонифицированной фенестрации является на сегодняшний день крайне актуальной.
Цель работы
Разработка универсального стент-графта для эндоваскулярного лечения аневризм аорты различной локализации, без учета анатомических параметров сосуда.
Материал и методы
Универсальность разрабатываемой конструкции явилась причиной того, что в качестве каркаса мы использовали плетеный саморасширяющийся стент из нитинола. Наружная оболочка стент-графта фиксировалась к каркасу узловыми швами из небиодеградируемой хирургической нити.
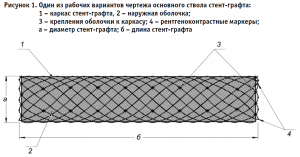
Каркас основного ствола графта выполнен в виде плетеной нитиноловой саморасширяющейся сетки с вариабельностью диаметра 20–50 мм и длиной 150–200 мм. Проксимальный и дистальный концы стент-графта отмечены рентгеноконтрастными маркерами (рис. 1). Ячейки имеют ромбовидную форму и изменяют свою конфигурацию в соответствии с диаметром аорты.
Модули – ответвления для протезирования ветвей аорты, попадающих в зону имплантации основного ствола (рис. 2А), для снижения опасности дислокации из основного ствола в дистальном направлении и в то же время профилактики пролабирования в основной просвет конструкции были выполнены в форме, подобной полому «гвоздю» с ограничительной шляпкой (рис. 2Б). Интраоперационные рентгенограммы при тестовых имплантациях опытных образцов в силиконовый фантом подтвердили преимущества данного образца.
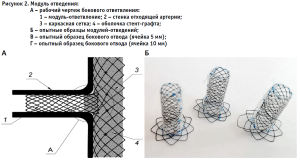

Пробная сборка моделей стент-графта из модулей различной конфигурации показала, что размер ячейки основного модуля не может быть менее 1 см, иначе возникает странгуляция модуля ответвления с последующим стенозированием его просвета у основания (рис. 2В), при размере ячейки, соответствующем диаметру бокового отвода, стеноз не возникает (рис. 2Г). Кроме того, чрезмерно жесткий каркас значимо ограничивает возможность конструкции адаптироваться к внутреннему рельефу аорты. Исходя из полученных результатов, были выбраны оптимальные жесткость и диаметр нитиноловой проволоки, из которой выполняется каркас изделия.
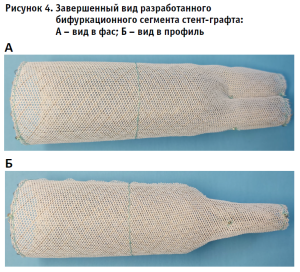
При разработке бифуркационного модуля была поставлена задача упростить и обезопасить процедуру позиционирования конструкции во время имплантации. Длина сегмента конструкции при максимальном растяжении составляет 30 мм, что позволяет не опасаться перекрытия устьев почечных артерий во время установки изделия. Саморасширяемость стента в случае необходимости позволяет достраивать проксимальный конец конструкции линейными модулями подобно черепице. В дистальном конце графт разделен стяжкой, разделяющей просвет на две равные части с формированием отверстий для фиксации подвздошных сегментов. Для эндопротезирования подвздошного сегмента был разработан линейный стент-графт, фиксирующийся в просвет восьмиобразного профиля бифуркационного модуля (рис. 3 и 4).

Окончательный вид разработанного сегмента представлен на рис. 4.
Основным фрагментом нашей работы был выбор тканого покрытия стенки графта. В качестве основы, как наиболее подходящий целям и задачам работы, был выбран лавсан (полиэтилентерефталат), так как многолетний опыт применения этого материала в медицинских изделиях для сосудистой хирургии доказал его прочность и биологическую инертность. Линейная растяжимость ткани в одном из направлений должна составлять не менее 150% от исходной длины, чтобы обеспечить равномерность покрытия каркаса с изменяемыми размерами.
Проницаемость для гепаринизированной крови должна быть тотальной, переходящая в нулевую после инактивации гепарина. Кроме того, при выборе ткани оценивалась степень компактности ворса, как предиктора тромбоза просвета стент-графта (рис. 5).


После выбора оптимального по структуре волокон лавсана провели исследования прочности материала на разрыв, что крайне важно на этапе дилатации фенестрации стенки графта (рис. 6).

Для испытаний прочности через ячейку фиксированного на стенде фрагмента лавсанового полотна по проводнику заводился баллонный катетер рабочим диаметром 8 мм. После чего через шприц высокого давления в баллон нагнеталась жидкость. Катетер раскрывался до максимального диаметра при давлении 10 атм.
По результатам испытаний был выбран материал со следующими параметрами: волокнистые или монофиламентные нити, толщиной от 0,05 до 0,1 мм, скрученные попарно и сплетенные в цепочку. Сплетенные нити дополнительно формируют сетку с 6–8 угольными ячейками, с условным диаметром 0,3–0,5 мм. Толщина получившегося материала не превышала 0,2 мм. Во время баллонной дилатации отмечались разрывы одной-двух нитей материала, без образования «стрелок». За счет характера плетения порванные нити плотно стягивались петлями «цепочек» по периметру отверстия. Отдельно проверяли пористость стенки из полиэтилентерефталатной ткани с различной плотностью, формой плетения, размерами ячейки, диаметром и свойствами нити.
Для испытаний опытных образцов был собран стенд, представляющий собой симуляционную модель артериальной системы с артериальным кровотоком. С целью обеспечения контроля объемной скорости кровотока, давления, температуры и времени циркуляции крови по контуру, система была собрана на базе аппарата искусственного кровообращения MaquetHL20 и использовала его штатные средства (рис. 7).

Для оценки гепарин-контролируемой хирургической порозности материала стенки контур полностью заполнялся гепаринизированной кровью из расчета 5000 ЕД гепарина на 80 кг массы тела условного пациента (рис. 8). Во время эксперимента кровь непрерывно прокачивалась по системе в течение 7600 с (2,1 ч), по истечении которых был взят анализ крови на газовый состав, каолиновое время, проведено центрифугирование для исключения признаков гемолиза. Затем в систему вводился протамина сульфат в количестве 0,5 мг с целью нейтрализации гепарина. Отслеживалось максимальное значение градиента давления между основным и отводящим контурами, время его достижения. Срабатывание сигнализации означало появление вакуума в отводящей магистрали и полную герметизацию просвета основного контура. Все этапы исследования проводились минимум дважды, для каждого образца ткани.

Для удобства имплантации стент-графта были разработаны оригинальные системы доставки линейных сегментов. Отдельной задачей явилась разработка устройства для осуществления персонифицированной фенестрации, доставки модуля-отведения (рис. 9).

Методика установки стент-графта
Установку предлагаемого стент-графта при эндопротезировании аневризм аорты осуществляли при помощи оригинальной системы доставки на фоне применения гепарина и ретгеноконтрастного вещества (Омнипак). Устройство доставляли к месту установки по сверхжесткому проводнику, предварительно установленному в аорте через его ствол до устья ветви аорты. Позиционирование осуществляли в режиме Road Map по рентгеноконтрастным меткам на модуле. Фенестрацию стенки основного ствола стент-графта выполняли гидрофильным проводником напротив устья перекрытой ветви аорты. Такой способ фенестрации исключал необходимость выполнения у пациента дополнительных хирургических доступов в периферические отделы вовлеченных сосудов. Следующим шагом через фенестрированную стенку в отходящую артерию по проводнику заводили и раскрывали модуль-ответвление с обязательной постдилатацией баллонным катетером. После чего баллон и проводник удаляли. Важно отметить, что такой способ бранширования использовали для каждой перекрытой магистральной ветви. Гепаринизацию «пациента» и сохранение эндолика IV типа продолжали до окончания установки всех необходимых модулей.
Результаты
Испытания на стенде. В отличие от большинства стент-графтов, где эндолик нежелателен, предлагаемый нами графт выполнен с возможностью временного сохранения эндолика IV типа. Это позволяет сохранить кровоснабжение жизненно важных органов на всю процедуру имплантации основного ствола и необходимого количества периферических модулей до момента нормализации кровоснабжения, а также для получения рентгеноанатомии в процессе имплантации.
В результате исследования было выявлено, что оптимальным для наружной оболочки изделия является лавсановое полотно (полиэтилентерефталат), в основе которого монофиламентные нити толщиной до 0,1 мм двойного плетения с диаметром ячеек 0,5 мм. Испытание опытных образцов стент-графтов на стенде, симулирующем модель артериального кровотока, показало, что материал оболочки разработанного устройства обладает гепарин-контролируемой хирургической пористостью от 50 до 150 мл/мин/см2 при давлении 120 мм рт. ст. с возможностью сохранения управляемого эндолика II типа. На фоне гепарина стенка графта создает градиент давления 3–5 мм рт. ст., а скоростные показатели потока вполне достаточны для адекватной перфузии жизненно важных органов и создания рентгенологической «дорожной карты» на фоне применения ретгеноконтрастного вещества, что необходимо для точной фенестрации и дальнейшего протезирования магистральных ветвей аорты.
Через 510 с после дегепаринизации крови пористость выбранного материала стенки графта становится нулевой. Это позволяет полностью изолировать полость аневризмы от кровотока в просвете стент-графта и ликвидировать эндолик IV типа.
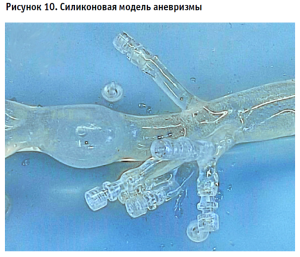
Испытания на фантоме. Демонстрация этапов имплантации изделия. На силиконовом фантоме аорты моделировалось аневризматическое расширение с расслоением и без него (рис. 10).
Контур силиконового фантома аорты заполнили кровезаменяющим раствором, моделирующим реологические свойства нативной крови. С помощью перфузионного насоса был создан пульсирующий кровоток с максимальным давлением 200 мм. рт. ст. (рис. 11).

Под контролем мобильной ангиографической установки Phillips Veradius смоделирован процесс эндопротезирования брюшного отдела аорты. По сверхжесткому проводнику, проведенному через подвздошную артерию в брюшную аорту, был имплантирован стент-графт, который позиционировался и устанавливался в зону смоделированного расширения таким образом, чтобы верхняя граница конструкции находилась на уровне почечных артерий. Контроль осуществлялся с использованием препарата Омнипак. После установки выполнялась постдилатация стента баллоном большого диаметра (рис. 12).
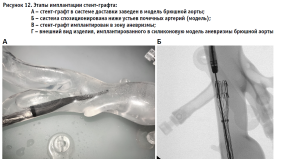
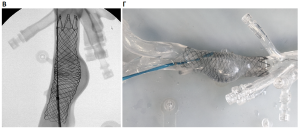
Следующим этапом работы была отработка технологии имплантации стент-графта в дугу аорты с последующим фенестрированием основного ствола изделия и эндопротезированием брахиоцефальных артерий.
Таким образом, были решены основные технические вопросы по разработке системы универсального стент-графта, однако нельзя не отметить организационное решение, подсказанное нам в ходе подготовки к регистрации медицинского изделия работниками разрешительной системы в структуре Министерства здравоохранения РФ, о необходимости регистрировать каждый сегмент в отдельности. Это позволит добиться значимого экономического эффекта для практической медицины, так как в ходе конкретной процедуры эндоваскулярный хирург сможет подбирать персонифицированный набор из различных составляющих, необходимый каждому пациенту индивидуально.
Заключение
Проведенные экспериментальные исследования показали, что разработанные изделия могут стать прообразом системы универсального стент-графта для лечения аневризм аорты любой локализации независимо от диаметра и анатомии аорты.
Модульность каркаса и его способность адаптироваться к изменениям диаметра и рельефа артерии значимо расширит возможности эндоваскулярного метода лечения у пациентов с многоуровневым аневризматическим поражением грудной и брюшной аорты.
Оригинальная конструкция стент-графта позволит упростить процедуру позиционирования и имплантации, уменьшить протяженность и травматичность оперативного вмешательства.
Благодаря способности материала стенки к управляемой проницаемости для крови значительно снизится время и степень ишемии внутренних органов, кровоснабжение которых осуществляется из ветвей аорты, попадающих в зону имплантации.
Организационное решение, предложенное специалистами разрешительной системы Министерства здравоохранения РФ, суть которого состоит в регистрации каждого сегмента в отдельности, будет способствовать достижению более значимого экономического результата для практической медицины.
- Yei K., Mathlouthi A., Naazie I. et al. Long-term Outcomes Associated with Open vs Endovascular Abdominal Aortic Aneurysm Repair in a Medicare-Matched Database // JAMA Netw Open. 2022; 5(5): e2212081. DOI: 10.1001/jamanetworkopen.2022.12081.
- Fang G., Yue J., Shuai T. et al. Comparison between endovascular aneurysm repair-selected and endovascular aneurysm repair only strategies for the management of ruptured abdominal aortic aneurysms: An 11-year experience at a Chinese tertiary hospital // Front Cardiovasc Med. 2022; 9: 870378. DOI: 10.3389/fcvm.2022.
- Кунгурцев В.В., Черкашов А.М., Черная Н.Р. и др. Эндопротезирование инфраренальных аневризм брюшной аорты у пациентов пожилого и старческого возраста // Ангиология и сосудистая хирургия. Журнал имени академика А.В. Покровского. – 2022. – Т. 28. – № 2. – С. 95–101. DOI: 10.33029/1027-6661-2022-28-2-95-101.
- Шломин В.В., Бондаренко П.Б., Шлойдо Е.А. и др. Эффективность гибридного хирургического лечения аневризм дуги и нисходящего отдела грудной аорты // Вестник хирургии им. И.И. Грекова. – 2022. – Т. 181. – № 1. – С. 11–20. DOI: 10.24884/0042-4625-2022-181-1-11.
- Бондаренко П.Б., Шломин В.В., Шлойдо Е.А. и др. Эндоваскулярное и гибридное лечение аневризм и расслоений грудной и торакоабдоминальной аорты // Ангиология и сосудистая хирургия. – 2021. – Т. 27. – № 2. – С. 50–61. DOI: 10.33529/ANGIO2021215.
- Xodo A., D’Oria M., Mendes B. et al. Peri-Operative Management of Patients Undergoing Fenestrated-Branched Endovascular Repair for Juxtarenal, Pararenal and Thoracoabdominal Aortic Aneurysms: Preventing, Recognizing and Treating Complications to Improve Clinical Outcomes // J Pers Med. 2022; 12(7): 1018. DOI: 10.3390/jpm12071018.
