ФАРМАКОНАДЗОР
Системный подход в эффективной организации фармаконадзора на региональном уровне (10-летний опыт на примере Алтайского края)
1 — Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Алтайскому краю, 656038, Российская Федерация, г. Барнаул, Комсомольский проспект, д. 118.
2 — ГБОУ ВПО «Алтайский государственный медицинский университет» Министерства здравоохранения Российской Федерации, 656038, Российская Федерация, г. Барнаул, проспект Ленина, д. 40/62.
3 — Территориальный орган Федеральной службы по надзору в сфере здравоохранения по Алтайскому краю, 656038, Российская Федерация, г. Барнаул, Комсомольский проспект, д. 118.
В статье представлен обзор требований законодательства в области фармаконадзора, приведены критерии оценки работы организаций по фармаконадзору, рассмотрены вопросы организации мониторинга безопасности лекарственных препаратов на уровне субъекта Российской Федерации.
Ключевые слова: фармаконадзор, обязательные требования, спонтанные сообщения о нежелательных реакциях при применении лекарственных препаратов
Безопасность медицинской деятельности, включая ее лекарственную составляющую, является одним из приоритетов здравоохранения, а эффективное и безопасное применение лекарственных препаратов – важнейшей составляющей качества медицинской помощи. Современная фармакотерапия строится на принципах безопасности и эффективности применения лекарственных средств [1]. Вместе с тем, в условиях постоянно растущего ассортимента лекарственных препаратов и все более широкого использования их в лечебной практике, увеличиваются и риски/угрозы неблагоприятного воздействия на организм, реализация которых влечет за собой тяжелые осложнения, в том числе и летальные исходы. Установлено, что ошибки при использовании лекарственных препаратов входят в число ведущих причин нанесения предотвратимого вреда пациентам в медицинских организациях всего мира [2].
В связи с этим система управления медицинскими рисками, включая фармакотерапевтические, является важным основополагающим компонентом безопасной медицинской деятельности [3].
Важный вклад в обеспечение эффективного и безопасного применения лекарственных препаратов вносит анализ данных, полученных в рамках фармаконадзора (мониторинга безопасности лекарственных препаратов), целями которого являются: выявление и предотвращение возможных негативных последствий применения лекарственных препаратов, случаев индивидуальной непереносимости; предупреждение медицинских работников и защита пациентов; обеспечение эффективности лекарственной терапии.
Мониторинг безопасности лекарственных препаратов играет значимую роль в решении задач, возникающих в результате постоянного увеличения ассортимента и широкого использования лекарственных препаратов, при применении которых нередко возникают побочные реакции, которые могут причинить непоправимый вред здоровью пациента и даже стать причиной летального исхода.
Основной составляющей фармаконадзора является система сбора спонтанных сообщений о нежелательных, непредвиденных реакциях организма на применение лекарственного препарата. Анализ полученных данных позволяет выявлять риски фармакотерапии, а также принимать необходимые управленческие решения с целью их нивелирования.
В связи с этим должная организация фармаконадзора на всех уровнях обращения лекарственных препаратов определяет как его эффективность, так и безопасность фармакотерапии и медицинской деятельности в целом.
Уполномоченным органом по организации и проведению фармаконадзора в Российской Федерации является Федеральная служба по надзору в сфере здравоохранения1, в связи с чем важную роль в организации фармаконадзора на региональном уровне занимает деятельность территориального органа Росздравнадзора.
Требования законодательства Российской Федерации к субъектам обращения лекарственных средств
В соответствии с положениями Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (пункт 5 части 2 статьи 73) медицинские и фармацевтические работники обязаны сообщать уполномоченному должностному лицу организации информацию, предусмотренную частью 3 статьи 64 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств»2.
Согласно части 3 статьи 64 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» субъекты обращения лекарственных средств обязаны сообщать в уполномоченный федеральный орган исполнительной власти о побочных действиях, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека при применении лекарственных препаратов и выявленных на всех этапах обращения лекарственных препаратов в Российской Федерации и других государствах.
В соответствии с частью 6 статьи 64 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств, за несообщение или сокрытие информации, предусмотренной частью 3 настоящей статьи (о побочных действиях, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека при применении лекарственных препаратов и выявленных на всех этапах обращения лекарственных препаратов), должностные лица, которым эта информация стала известна по роду их профессиональной деятельности, несут ответственность в соответствии с законодательством Российской Федерации3.
Порядок осуществления фармаконадзора в Российской Федерации утвержден приказом Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора»4 (далее – приказ от 15.02.2017 № 1071). Согласно пунктам 35–36 приказа от 15.02.2017 № 1071, субъекты обращения лекарственных средств (медицинские организации) обязаны сообщать в Росздравнадзор:
- в срок не более 3 рабочих дней – о серьезных нежелательных реакциях с летальным исходом или угрозой жизни, за исключением нежелательных реакций, выявленных в ходе проведения клинических исследований, проводимых в данной медицинской организации.
- в срок, не превышающий 15 календарных дней, – о нежелательных реакциях и иной информации по безопасности и эффективности, за исключением нежелательных реакций, выявленных в ходе проведения клинических исследований:
1) серьезных нежелательных реакциях на лекарственные препараты, за исключением серьезных нежелательных реакций с летальным исходом или угрозой жизни;
2) случаях передачи инфекционного заболевания через лекарственный препарат;
3) случаях отсутствия заявленной эффективности лекарственных препаратов, применяемых при заболеваниях, представляющих угрозу для жизни человека, вакцин для профилактики инфекционных заболеваний, лекарственных препаратов для предотвращения беременности, когда отсутствие клинического эффекта не вызвано индивидуальными особенностями пациента и (или) спецификой его заболевания;
4) нежелательных реакциях, возникших вследствие злоупотребления препаратом, в случаях умышленной передозировки лекарственного препарата, при воздействии, связанном с профессиональной деятельностью, или в случаях использования лекарственного препарата в целях умышленного причинения вреда жизни и здоровью человека.
Срок для сообщения о нежелательных реакциях и иной информации по безопасности и эффективности, указанной в пунктах 35–36 приказа от 15.02.2017 № 1071, исчисляется с даты, когда ответственному по фармаконадзору должностному лицу субъекта обращения лекарственных средств (медицинской организации) стали известны следующие сведения о нежелательной реакции или особой ситуации:
1) информация, позволяющая идентифицировать юридическое или физическое лицо, выявившее нежелательную реакцию или особую ситуацию;
2) информация, позволяющая идентифицировать физическое лицо, у которого наблюдалась нежелательная реакция;
3) информация, позволяющая идентифицировать лекарственный препарат;
4) информация, позволяющая идентифицировать симптомы нежелательной реакции.
Также, согласно пункту 37 приказа от 15.02.2017 № 1071, медицинские организации обязаны сообщать о случаях индивидуальной непереносимости лекарственных средств, явившихся основанием для выписки лекарственных препаратов по торговому наименованию в рамках программ льготного лекарственного обеспечения, в порядке, установленном приказом Минздрава России от 05.05.2012 № 502н «Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации»5 в срок, не превышающий пяти рабочих дней с даты выписки соответствующего лекарственного препарата по торговому наименованию.
Мониторинг неблагоприятных побочных действий лекарственных препаратов, в том числе серьезных и непредвиденных нежелательных реакций, связанных с применением лекарственных препаратов, является одной из функций врачей – клинических фармакологов медицинской организации, оказывающей медицинскую помощь по профилю «клиническая фармакология».6
Согласно статье 90 Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организациями государственной, муниципальной и частной систем здравоохранения должен осуществляться внутренний контроль качества и безопасности медицинской деятельности.
В соответствии с Требованиями к организации и проведению внутреннего контроля качества и безопасности медицинской деятельности, утвержденными приказом Минздрава России от 31.07.2020 № 785н7, медицинской организацией осуществляется анализ информации: о побочных действиях, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека при применении лекарственных препаратов и выявленных на всех этапах обращения лекарственных препаратов, сообщаемой медицинской организацией в уполномоченный федеральный орган исполнительной власти. Соблюдение требований, предъявляемых к осуществлению внутреннего контроля качества и безопасности медицинской деятельности, в соответствии с положениями постановления Правительства РФ от 01.06.2021 № 852 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково») и признанием утратившими силу некоторых актов Правительства Российской Федерации»8, является одним из лицензионных требований при осуществлении медицинской деятельности.
Для оценки работы медицинских организаций по фармаконадзору, организации аудита системы фармаконадзора Росздравнадзором разработаны и рекомендованы Критерии9:
- Знание сотрудниками медицинской организации законодательства в сфере мониторинга безопасности лекарственных средств (Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» и приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении порядка осуществления фармаконадзора»).
- Наличие внутренних приказов, регламентирующих порядок регистрации и сбора информации о нежелательных реакциях в медицинской организации и передачу сведений о них в Росздравнадзор.
- Наличие специалистов, ответственных за сбор и направление информации о нежелательных реакциях и проблемах безопасности лекарственных препаратов в Росздравнадзор.
- Организация взаимодействия с территориальным органом Росздравнадзора. Организация информирования центрального аппарата Росздравнадзора или территориальных органов Росздравнадзора по субъектам Российской Федерации о летальных нежелательных реакциях на лекарственные препараты в течение 3 рабочих дней с момента, когда произошла данная реакция.
- Наличие персонализированного доступа в базу данных «Фармаконадзор 2.0» Автоматизированной информационной системы Росздравнадзора (http://external. roszdravnadzor.ru).
- Среднее число выявляемых нежелательных реакций, количество сообщений, направленных в Росздравнадзор.
- Наличие навыков заполнения извещений о нежелательной реакции на лекарственные препараты (в электронной форме или на бумажном носителе).
- Фиксация сведений о выявленных в медицинской организации нежелательных реакциях на лекарственные препараты в медицинской документации пациентов.
- Направление в течение 5 рабочих дней врачебными комиссиями извещений о случаях индивидуальной непереносимости, явившихся основанием для выписки лекарственных препаратов по торговым наименованиям.
- Обсуждение вопросов фармаконадзора на совещаниях, проводимых руководством медицинской организации (утренние конференции, планерки).
- Консультирование медицинского персонала, проведение совещаний, учебных семинаров, направленных на повышение сообщаемости и качества сообщений о нежелательных реакциях при применении лекарственных препаратов.
Порядок же направления фармацевтическими организациями сообщений о неблагоприятных побочных реакциях при применении лекарственных препаратов и иной информации о безопасности и эффективности лекарственных препаратов приказом Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора» не определен.
В то же время, согласно правилам надлежащей аптечной практики лекарственных препаратов для медицинского применения, утвержденным приказом Минздрава России от 31.08.2016 № 647н10, руководитель субъекта розничной торговли обеспечивает проведение по утвержденному им плану-графику первичной и последующей подготовки (инструктажа) работников по методам обработки данных, полученных от покупателей по вопросам применения лекарственных препаратов, выявленным в процессе применения, побочным действиям, доведения этой информации до заинтересованных лиц.
Опыт организации и осуществления мониторинга безопасности лекарственных препаратов в Алтайском крае
Медицинскую деятельность в Алтайском крае осуществляют более 1200 организаций, из них 75% – негосударственной формы собственности и 25% (310) – государственной.
Мониторинг безопасности лекарственных препаратов в государственных организациях был организован в Алтайском крае территориальным органом Росздравнадзора совместно с органом государственной власти субъекта Российской Федерации в сфере здравоохранения в 2009 году. С целью эффективного сбора спонтанных сообщений о неблагоприятных побочных реакциях лекарственных препаратов были определены основные задачи:
- обеспечение единого понимания обязательных требований у всех участников мониторинга безопасности лекарственных препаратов;
- назначение в каждой медицинской организации лиц, уполномоченных на проведение фармаконадзора;
- формирование у субъектов обращения лекарственных препаратов мотивации на обязательность исполнения требований законодательства в части мониторинга безопасности лекарственных препаратов;
- выявление причин, факторов и условий, способствующих нарушению обязательных требований и определение способов устранения или снижения рисков их возникновения.
В период организации в крае системы фармаконадзора в 172 государственных медицинских организациях, подведомственных органу государственной власти субъекта РФ в сфере здравоохранения, приказами главных врачей были назначены ответственные за мониторинг безопасности лекарственных препаратов, которыми являлись заместители главного врача по медицинской части (75%) и врачи – клинические фармакологи (25%).
В целях эффективного сбора необходимых сведений с вовлечением всех заинтересованных лиц, единого понимания предъявляемых требований было организовано информационное обеспечение по вопросам фармаконадзора.
Так, на официальном сайте территориального органа Росздравнадзора в сети Интернет (http://22.reg.roszdravnadzor.ru) размещались материалы по вопросам организации мониторинга безопасности лекарственных препаратов, нормативные правовые акты, устанавливающие требования к осуществлению фармаконадзора, пресс-релизы. С руководителями всех медицинских организаций, ответственными должностными лицами и врачами проводилась информационно-разъяснительная работа. В 2010 году проведена пресс-конференция на тему «Организация фармаконадзора в Алтайском крае».
С целью организации фармаконадзора не только в медицинских, но и в социальных учреждениях, территориальным органом Росздравнадзора в рамках межведомственного взаимодействия проводились совещания с представителями органов государственной власти субъекта Российской Федерации в сфере здравоохранения и в сфере социальной защиты. По итогам совещаний были приняты резолюции, в соответствии с которыми активно велась работа по организации в крае фармаконадзора в медицинских и социальных учреждениях, осуществляющих медицинскую деятельность, в том числе во всех социальных учреждениях также были назначены ответственные за фармаконадзор лица.
Территориальным органом Росздравнадзора организован мониторинг количества сообщений о неблагоприятных побочных реакциях при применении лекарственных препаратов в разрезе медицинских организаций, которые постепенно включались в деятельность по фармаконадзору. Так, по итогам 2011 года 40% государственных медицинских организаций (69) направили в Росздравнадзор сообщения о неблагоприятных побочных реакциях при применении лекарственных препаратов; по итогам 2012 года – 50% медицинских организаций (87); по итогам 2015 года – 65% (111).
Информация о результатах мониторинга безопасности лекарственных препаратов регулярно направлялась Главному Федеральному инспектору по Алтайскому краю, заместителю губернатора Алтайского края, в орган государственной власти субъекта РФ в сфере здравоохранения, медицинские организации.
В целях дальнейшей активизации фармаконадзора, тиражирования полученного опыта результаты работы были представлены на межрегиональных научно-практических конференциях, в том числе в Новосибирской области, Республике Алтай, опубликованы в научных журналах [4–11].
Существенный вклад в организацию мониторинга безопасности лекарственных препаратов в крае внесло издание в 2013 году Методического пособия «Организация мониторинга безопасности лекарственных препаратов» [12] для организаторов здравоохранения, практикующих врачей, курсантов факультетов повышения квалификации, студентов старших курсов высших медицинских образовательных учреждений.
Методическое пособие содержало подробные сведения о нормативных правовых требованиях, информацию о системе фармаконадзора, ее участниках, функциональных задачах всех участников системы фармаконадзора; алгоритм их взаимодействия; практические рекомендации по организации мониторинга безопасности лекарственных препаратов; данные о причинах развития и классификацию неблагоприятных побочных реакций лекарственных препаратов; вопросы профилактики осложнений фармакотерапии.
Вопросы соблюдения обязательных требований по фармаконадзору оценивались при проведении контрольных (надзорных) мероприятий, по результатам которых при выявлении нарушений принимались предусмотренные законодательством меры (табл. 1).

В период реформы контрольной (надзорной) деятельности и в настоящее время при смене парадигмы осуществления контроля (надзора) приоритетным направлением деятельности, в том числе по вопросам фармаконадзора, является организация профилактических мероприятий.
С целью соблюдения нормативных требований по фармаконадзору территориальным органом Росздравнадзора по Алтайскому краю на регулярной основе осуществляются профилактические мероприятия в форме:
- информирования подконтрольных субъектов по вопросам соблюдения обязательных требований посредством размещения информации, в том числе текстов нормативных правовых актов, содержащих обязательные требования по фармаконадзору, на официальном сайте, публикаций в печатных изданиях, средствах массовой информации, выступлений на телевидении, радио; направления информационных писем, в том числе о результатах мониторинга безопасности лекарственных препаратов (количестве сообщений) в разрезе медицинских организаций, проведения публичных обсуждений правоприменительной практики, конференций, совещаний с подконтрольными субъектами и органом государственной власти субъекта в сфере здравоохранения и др.;
- консультирования подконтрольных субъектов по вопросам соблюдения обязательных требований по фармаконадзору;
- направления предостережений о недопустимости нарушения обязательных требований;
- проведения профилактических визитов.
В случае непринятия организацией должных мер по соблюдению обязательных требований по результатам проведения одного вида профилактических мероприятий может быть дополнительно использован другой. Например, профилактический визит после объявления предостережения о недопустимости нарушения обязательных требований.
Схема осуществляемых территориальным органом Росздравнадзора по Алтайскому краю профилактических мероприятий, направленных на соблюдение требований законодательства по фармаконадзору, представлена на рисунке 1.
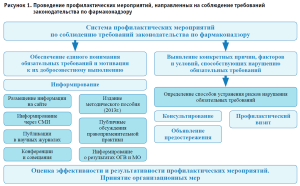
Систематически осуществляемый территориальным органом Росздравнадзора анализ результатов мониторинга безопасности лекарственных препаратов в разрезе медицинских организаций позволил установить причины, способствующие нарушению требований законодательства по фармаконадзору, в том числе:
- незнание или неправильное трактование сотрудниками медицинских организаций требований законодательства;
- недостаточный уровень внутреннего контроля качества и безопасности медицинской деятельности, неэффективная работа врачебной комиссии;
- отсутствие у сотрудников медицинской организации мотивации к соблюдению обязательных требований, непонимание актуальности и значения фармаконадзора;
- кадровый дефицит в медицинских организациях, отсутствие в штате врачей – клинических фармакологов;
- отсутствие в медицинской организации четкого алгоритма взаимодействия сотрудников для обеспечения направления информации в Росздравнадзор;
- наличие данных о неблагоприятных побочных реакциях в инструкциях по медицинскому применению лекарственных препаратов;
- принятие врачами лекарственных осложнений за вновь возникшие заболевания;
- длительный промежуток времени между возникновением неблагоприятных побочных реакций и применением лекарственных препаратов;
- недостаточность информации для направления;
- боязнь ответственности.
Полученные данные используются при проведении профилактических мероприятий по соблюдению обязательных требований фармаконадзора, включая консультирование и профилактические визиты.
Проводимые территориальным органом Росздравнадзора по Алтайскому краю в 2009–2022 гг. мероприятия, в том числе контрольная (надзорная) и профилактическая деятельность; активное взаимодействие с органом государственной власти субъекта в сфере здравоохранения и медицинскими организациями; уделение особого внимания многопрофильным медицинским организациям и медицинским организациям, применяющим лекарственные препараты с большим риском возникновения неблагоприятных побочных реакций, например, лекарственные препараты для лечения больных с онкологическими заболеваниями; назначение во всех государственных организациях ответственных лиц, в том числе в 25% медицинских организациях врачей – клинических фармакологов, индивидуальная информационная работа с представителями каждой медицинской организации, позволили обеспечить за этот период организацию в регионе эффективного мониторинга безопасности лекарственных препаратов.
Так, количество спонтанных сообщений в среднем составляет 68,2 на 100 тыс. населения, а за последние три года (2019– 2021 гг.) – 99,4 на 100 тыс. населения (табл. 2).

При этом количество спонтанных сообщений на 100 тыс. населения является основным методом оценки сообщаемости. По информации регуляторных агентств США и Великобритании, количество сообщений, ежегодно направляемых в регуляторные органы указанных стран, составляет 72 и 40 сообщений на 100 тыс. населения соответственно. В России средний показатель установлен на уровне 9 сообщений на 100 тыс. населения [1].
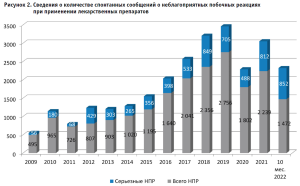
Всего за период 2009 г. – 10 мес. 2022 г. медицинскими организациями Алтайского края направлено в Федеральную службу по надзору в сфере здравоохранения 20 417 спонтанных сообщений о неблагоприятных побочных реакциях при применении лекарственных препаратов, в том числе – 7051 сообщений о серьезных нежелательных реакциях (35,5%) (рис. 2).
Заключение
Организованная в Алтайском крае система фармаконадзора обеспечила стабильно высокие показатели по количеству направляемых сообщений, что является одним из системных аспектов обеспечения безопасности применения лекарственных препаратов.
С 2010 года по настоящее время Алтайский край занимает лидирующие позиции в Российской Федерации по количеству спонтанных сообщений о неблагоприятных побочных реакциях при применении лекарственных препаратов, что было неоднократно отмечено в публикациях журнала «Вестник Росздравнадзора» [1, 13, 14].
Представленный опыт по организации в Алтайском крае мониторинга безопасности лекарственных препаратов и полученные результаты свидетельствуют об эффективности проводимых территориальным органом Росздравнадзора контрольных (надзорных) и профилактических мероприятий.
Представленная из региона Российской Федерации в рамках фармаконадзора информация вносит ценный вклад в общие результаты фармаконадзора, имеет важное значение в принятии регуляторных решений по обеспечению эффективности и безопасности применения лекарственных препаратов.
______________________________________________________________________
1 Постановление Правительства РФ от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения» // Собрание законодательства РФ, 12.07.2004, № 28, ст. 2900.
2 Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» // Собрание законодательства РФ, 19.04.2010, № 16, ст. 1815.
3 Кодекс Российской Федерации об административных правонарушениях от 30.12.2001 № 195-ФЗ, ст. 19.7.8 // Собрание законодательства РФ, 07.01.2002, № 1 (ч. 1), ст. 1. Уголовный кодекс Российской Федерации от 13.06.1996 № 63-ФЗ, ст. 237 // Собрание законодательства РФ», 17.06.1996, № 25, ст. 2954.
4 Приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора». Официальный интернет-портал правовой информации. URL: http://www.pravo.gov.ru.
5 Приказ Минздравсоцразвития России от 05.05.2012 № 502н «Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации» // «Российская газета», № 141, 22.06.2012.
6 Приказ Минздрава России от 02.11.2012 № 575н «Об утверждении Порядка оказания медицинской помощи по профилю «клиническая фармакология» // «Российская газета», спецвыпуск, № 78/1, 11.04.2013.
7 Приказ Минздрава России от 31.07.2020 № 785н «Об утверждении Требований к организации и проведению внутреннего контроля качества и безопасности медицинской деятельности» // Официальный интернет-портал правовой информации http://www.pravo.gov.ru, 02.10.2020.
8 Постановление Правительства РФ от 01.06.2021 № 852 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково») и признании утратившими силу некоторых актов Правительства Российской Федерации» // Собрание законодательства РФ, 07.06.2021, № 23, ст. 4091.
9 Письмо Федеральной службы по надзору в сфере здравоохранения от 17.02.2020 № 02И-313/20 «Об организации работы фармаконадзора в медицинских организациях».
10 Приказ Минздрава России от 31.08.2016 № 647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». Официальный интернет-портал правовой информации. URL: http://www.pravo.gov.ru.
- Кудрявцева Е.М. Проведение фармаконадзора в медицинских организациях / Е.М. Кудрявцева, К.В. Горелов // Вестник Росздравнадзора. – 2021. – № 2. – С. 53– 7.
- ВОЗ призывает страны принять срочные меры для выполнения задачи «Лекарства без вреда» // ВОЗ: [сайт]. – URL: https://www.who.int/ru/news/item/16-09-2022-who-calls-for-urgentaction-by-countries-for-achieving-medication-without-harm (дата обращения: 17.01.2023).
- Самойлова А.В. Система управления медицинскими рисками – основополагающий компонент безопасной медицинской деятельности / А.В. Самойлова, А.В. Колоколов // Вестник Росздравнадзора. – 2021. – № 2. – С. 6 – 14.
- Трешутин В.А. Фармаконадзор как важнейшая составляющая контроля за обращением лекарственных средств / В.А. Трешутин, И.В. Москвитина // Современные подходы к обеспечению качества медицинской, лекарственной и социальной помощи на региональном уровне: Матер. межрегион. научно-практической конф. / под общей редакцией И.В. Нонуковой. – Горно-Алтайск, 2011. – С. 148.
- Трешутин В.А. Фармаконадзор – обеспечение безопасного использования лекарственных препаратов в Алтайском крае / В.А. Трешутин, И.В. Москвитина // ФПК и ППС АГМУ – практическому здравоохранению: Матер. Юбилейной научно-практической конф., посв. 25-летию факультета повышения квалификации и профессиональной переподготовки специалистов (Барнаул, 2011) / редкол. А.И. Алгазин, А.С. Петриков, С.А. Ельчанинова, А.В. Манукян. – Барнаул: Параграф, 2011. – С. 390.
- Трешутин В.А. Контроль безопасности лекарственных препаратов, используемых при медицинской реабилитации / В.А. Трешутин, И.В. Москвитина // Современные аспекты реабилитации в медицине: Матер. Всероссийской научно-практической конф., посв. 30-летию кафедры восстановительной медицины Алтайского государственного медицинского университета / Под редакцией профессора Т.В. Кулишовой. – Барнаул, 2011. – С. 256.
- Трешутин В.А. Концептуальные подходы к обеспечению качества медицинской помощи и ее контроля на уровне медицинского учреждения / В.А. Трешутин, И.В. Москвитина // Менеджмент качества в сфере здравоохранения. – 2012. – № 2 (12). – С. 84–90.
- Трешутин В.А. Актуальные вопросы организации внутреннего контроля качества и безопасности медицинской деятельности / В.А. Трешутин, И.В. Москвитина, В.И. Зайцев // Заместитель главного врача. – 2013. – № 9 (88). – С. 54–62.
- Трешутин В.А. Базовые аспекты организации и обеспечения контроля качества и безопасности медицинской деятельности на уровне медицинской организации / В.А. Трешутин, В.И. Зайцев, И.В. Москвитина // Управление качеством в здравоохранении. – 2014. – № 4. – С. 11–23.
- Трешутин В.А. Порядки оказания медицинской помощи и стандарты медицинской помощи как основа обеспечения качества и безопасности медицинской деятельности / В.А. Трешутин, В.И. Зайцев, И.В. Москвитина // Заместитель главного врача: лечебная работа и медицинская экспертиза. – 2014. – № 11(102). – С. 55–62.
- Барышников Е.Н. Оценка результативности и эффективности деятельности федеральных органов исполнительной власти (на примере территориального органа Федеральной службы по надзору в сфере здравоохранения по Алтайскому краю) / Е.Н. Барышников, И.В. Москвитина // «Ученые записки Алтайского филиала Российской академии народного хозяйства и государственной службы при Президенте Российской Федерации». – Вып. 12–13 (2015–2016 гг.). – С. 3–12.
- Трешутин В.А. Организация мониторинга безопасности лекарственных препаратов: метод. пос. для организаторов здравоохранения, интернов, ординаторов, врачей, слушателей ФПК и ППС, студентов старших курсов / В.А. Трешутин, И.В. Москвитина, В.И. Зайцев. А.И. Алгазин / Под ред. д.м.н., проф. В.А. Трешутина. – Барнаул: Алтайский государственный медицинский университет, 2013. – 36 с.
- Мурашко М.А. Об итогах работы Федеральной службы по надзору в сфере здравоохранения в 2016 г. и планах на 2017 г. / М.А. Мурашко // Вестник Росздравнадзора. – 2017. – № 2. – С. 5.
- Мурашко М.А. Об итогах работы Федеральной службы в сфере здравоохранения в 2017 г. и планах на 2018 г. / М.А. Мурашко // Вестник Росздравнадзора. – 2018. – № 2. – С. 5–15.
